ENLACE QUÍMICO EJERCICIOS RESUELTOS PDF
¿QUÉ ES UN ENLACE QUÍMICO?
Es el conjunto de fuerzas que mantienen unidos a las especies (átomos, iones, moléculas) con la finalidad de lograr una estructura más estable.
- CLIC AQUÍ Ver LEWIS–REGLA DEL OCTETO RESUELTOS
- Ver ENLACE IÓNICO
- Ver ENLACE METÁLICO
- Ver ENLACE COVALENTE
EJERCICIO 1 :
Marca verdadero (V) o falso (F) según corresponda , sobre los enlaces químicos.
I) Se producen cuando dos o más electrones están asociados con dos o más átomos .
II) Cuando dos átomos interactúan pueden hacerlo por compartición de electrones, por ganancia o pérdida de electrones .
III) El enlace metálico se establece entre elementos de baja electronegatividad .
IV) El enlace covalente se establece entre elementos no metálicos , por ganancia y pérdida de electrones.
A) VFVF
B) VFVV
C) VVVF
D) FFVV
E) VVVV
RESOLUCIÓN :
I) VERDADERO
Los enlaces químicos se originan de la interacción de dos átomos en relación a sus electrones .
II) VERDADERO
La interacción de electrones puede darse por compartición o por transferencia .
III) VERDADERO
El enlace metálico se produce por el equilibrio que existe entre los cationes metálicos y los electrones iones perdidos (esto debido a la baja electronegatividad) .
IV) FALSO
El enlace covalente se produce por compartición de electrones entre átomos de alta electronegatividad (no metales) .
Rpta. : "C"
EJERCICIO 2 :
Los factores predominantes en las propiedades de las sustancias son: el tipo de elemento, la proporción en la que intervienen y el tipo de enlace químico que los une.
Con respecto al enlace químico, seleccione el valor de verdad (V o F) de las siguientes proposiciones.
I) Es la fuerza que mantiene unidos a los átomos en una sustancia.
II) Se clasifica como iónico, covalente y metálico.
III) En el enlace metálico se presenta transferencia de electrones.
A) VFV
B) VVF
C) FVF
D) FFF
RESOLUCIÓN :
I) Verdadero
El enlace químico es la unión entre átomos. Cuando se forma un enlace químico entre dos átomos la energía de la sustancia resultante es menor que la energía de los átomos por separado.
II) Verdadero
Existen tres clases de enlace químico: metálico, iónico y covalente.
III) Falso
En el enlace metálico hay deslocalización de electrones, mientras que en el iónico ocurre una transferencia de electrones.
Rpta. : "B"
EJERCICIO 3 :
Cuando la diferencia de electronegatividades entre los átomos que forman un enlace es mayor a 7, generalmente se trata de un enlace:
A) Iónico
B) Metálico
C) Covalente
D) Covalente polar
E) Covalente no polar
RESOLUCIÓN :
Rpta. : "A"
EJERCICIO 4 :
Respecto a la clasificación de los enlaces químicos, señale las proposiciones verdaderas (V) o falsas (F):
I) Se clasifican en iónicos, covalentes y metálicos.
II) La regla del octeto se cumple en los tres tipos de enlace, indefectiblemente.
III) No existen enlaces 100% iónicos o covalentes .
A) VFV
B) VFF
C) FVF
D) FVV
E) FFF
RESOLUCIÓN :
I) VERDADERO
Los enlaces químicos interatómicos pueden ser: iónicos, covalentes y metálicos .
II) FALSO
La regla del octeto solo se puede aplicar a los elementos representativos pero aún en ellos hay excepciones.
III) VERDADERO
Todo enlace iónico tiene un porcentaje de covalente y viceversa; que se puede calcular conociendo las electronegatividades y aplicando la ecuación de Hannay – Smith.
Rpta. : "A"
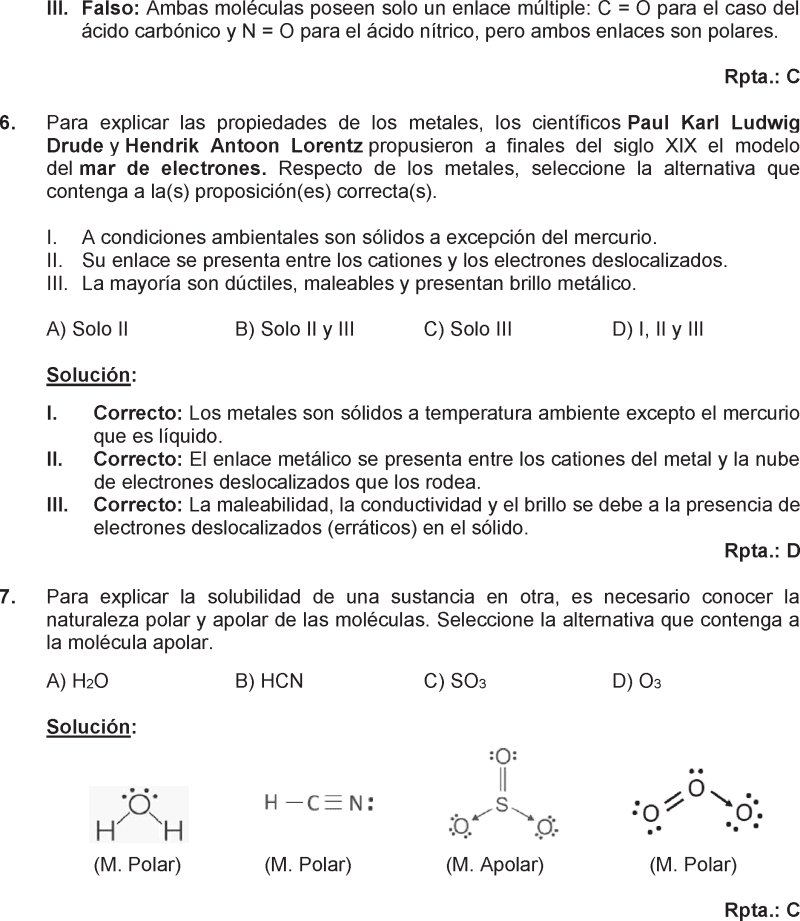
EJERCICIO 5 :
Las sustancias que encontramos en la naturaleza están formadas por diferentes tipos de enlace y por ello distintas aplicaciones, el SO2 como conservante, el CaO como desecante y el Au como metal precioso.
Al respecto, seleccione la alternativa que contenga, respectivamente, el tipo de enlace presente en cada una.
(a) SO2(g)
(b) CaO(s)
(c) Au(s)
Datos: Electronegatividad: Ca =1,0; O=3,5; S=2,6; Au=2,5
A) Metálico - iónico - covalente.
B) Iónico - covalente - covalente.
C) Covalente - metálico - iónico.
D) Covalente - iónico - metálico.
RESOLUCIÓN :
(a) SO2(g): Los átomos de oxígeno se encuentran unidos al azufre compartiendo sus electrones, dando origen al enlace covalente.
(b) CaO(s): El calcio y el oxígeno al formar el compuesto CaO lo hacen por medio de una transferencia de electrones del metal al no metal, formando iones de cargas opuestas, los cuales se atraen por fuerzas electrostáticas llamadas enlace iónico.
(c) Au: Al ser un metal, los átomos están enlazados entre sí por medio de enlaces metálicos, que resultan de la atracción entre sus cationes metálicos y electrones libres en movimiento.
Rpta. : "D"
EJERCICIO 6 :
Experimentalmente, y bajo condiciones muy especiales, se comprueba que una de las estructuras más representativas para el dióxido de dinitrógeno corresponde a una molécula lineal en la que todos los átomos retienen sus respectivos pares solitarios. Identifique la afirmación que corresponde a la representación de Lewis.
Datos: 7N y 8O
A) La molécula lineal presenta cuatro pares de electrones solitarios.
B) Los enlaces covalentes heteronucleares del N2O2 son no polares.
C) Los dos átomos de nitrógeno están unidos por un triple enlace.
D) Los dos átomos de nitrógeno forman un enlace covalente simple.
E) Los 3 átomos de nitrógeno están unidos por un doble enlace.
RESOLUCIÓN :
Rpta. : "D"
EJERCICIO 7 :
El número de enlaces sigma en cada uno de los siguientes compuestos:
I) N2O3
II) SiO2
III) C2H4
Son respectivamente:
A) 6, 4 y 6
B) 5, 3 y 5
C) 4, 2 y 4
D) 4, 2 y 5
E) 3, 2 y 4
RESOLUCIÓN :
Rpta. : "D"
EJERCICIO 8 :
De las siguientes fuerzas, indique verdadero (V) o falso (F) , si corresponde a un enlace químico :
I) Fuerza de atracción entre iones de carga opuesta.
II) Fuerza de atracción por compartición de electrones.
III) Fuerza de atracción dipolo – dipolo .
IV) Fuerzas de atracción entre cationes y electrones en un metal .
A) VVVV
B) VVVF
C) VVFV
D) VFVV
E) VVFF
RESOLUCIÓN :
Sobre los enlaces químicos se sabe que son fuerzas de atracción que se manifiestan de las formas siguientes :
Interatómicos (entre átomos)
iónico : Cargas opuestas de iones (electroestático)
Covalente : Compartición de electrones (electromagnéticos)
Rpta. : "A"
EJERCICIO 9 :
Para explicar las propiedades de los metales, los científicos Paul Karl Ludwig Drude y Hendrik Antoon Lorentz propusieron a finales del siglo XIX el modelo del mar de electrones.
Respecto de los metales, seleccione la alternativa que contenga a la(s) proposición(es) correcta(s).
I) A condiciones ambientales son sólidos a excepción del mercurio.
II) Su enlace se presenta entre los cationes y los electrones deslocalizados.
III) La mayoría son dúctiles, maleables y presentan brillo metálico.
A) Solo II
B) Solo II y III
C) Solo III
D) I, II y III
RESOLUCIÓN :
I) Correcto
Los metales son sólidos a temperatura ambiente excepto el mercurio que es líquido.
II) Correcto
El enlace metálico se presenta entre los cationes del metal y la nube de electrones deslocalizados que los rodea.
III) Correcto
La maleabilidad, la conductividad y el brillo se debe a la presencia de electrones deslocalizados (erráticos) en el sólido.
Rpta. : "D"
EJERCICIO 10 :
El número de enlaces no dativos en el ácido perclórico (HCℓO4) es
A) 0
B) 1
C) 2
D) 3
E) 4
RESOLUCIÓN :
Rpta. : "C"
EJERCICIO 11 :
Marque con verdadero(V)o falso(F), si corresponda:
I) Son enlaces interatómicos : El enlace covalente y las fuerzas de London .
II) Las fuerzas intermoleculares son mucho más débiles que los enlaces interatómicos .
III) El enlace metálico es una fuerza intermolecular.
A) VFF
B) FVF
C) VVF
D) FFV
E) VFV
RESOLUCIÓN :
I) FALSO:
Los enlaces indicados correspondiente a:
Covalente : interatómico .
Fuerzas de London : intermolecular .
II) VERDADERO
Los enlaces entre átomos generan interacciones fuertes (menor distancia) por eso son más intensos que los intermoleculares (mayor distancia) .
III) FALSO
El enlace metálico presente en todos los metales y sus aleaciones es del tipo interatómico, originado por atracción entre los cationes metálicos y los electrones libres por estos .
Metálico : Cationes y electrones libres .
(Electrostáticos).
Intermoleculares (entre moléculas)
Dipolo–Dipolo: Moléculas polares .
(Electroestático)
Fuerzas de london : polaridad inducida .
(Electroestático).
Con la relación al problema se observa que todas las fuerzas indicadas corresponden a enlaces químicos .
Rpta. : "B"
EJERCICIO 12 :
Respecto a los compuestos iónicos, la proposición incorrecta es:
A) Son sólidos a temperatura ambiente.
B) Fundidos son buenos conductores eléctricos.
C) Son solubles en agua.
D) Presentan bajos puntos de fusión comparados con los compuestos covalentes.
E) En soluciones acuosas son buenos conductores eléctricos.
RESOLUCIÓN :
Las principales propiedades físicas de los compuestos iónicos son
• A temperatura ambiente son sólidos de alta dureza.
• Fundidos o disueltos en agua son buenos conductores eléctricos (electrolitos).
• Son solubles en solventes polares, como el agua.
• Poseen altas temperaturas de fusión y ebullición, comparados con los compuestos covalentes.
• Son frágiles y quebradizos.
• Poseen atracciones polidireccionales.
Rpta. : "D"
EJERCICIO 14 :
Indique la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F).
I) La valencia es igual al estado de oxidación.
II) El estado de oxidación del Mn en el KMnO4 es +7.
III) La valencia del S en el H2SO4 es 4.
A) VFV
B) FFV
C) FVF
D) FVV
E) VFF
RESOLUCIÓN :
Rpta. : "C"
EJERCICIO 15 :
Una sustancia diamagnética, sin electrones desapareados, es ligeramente repelida por un campo magnético, mientras que una sustancia paramagnética, con electrones desapareados es atraída débilmente por un campo magnético.
¿Cuántas de las siguientes sustancias son paramagnéticas?
A) 1
B) 2
C) 3
D) 4
E) 5
RESOLUCIÓN :
Rpta. : "A"
EJERCICIO 16 :
Indique verdadero(V) o falso (F) las proposiciones siguientes :
I) El enlace iónico se forma entre un metal con baja energía de ionización y un no metal con elevada afinidad por los electrones.
II) Los compuestos iónicos son maleables.
III) Los compuestos iónicos no forman moléculas.
A) FVV
B) VVV
C) VVF
D) VFV
E) FFV
RESOLUCIÓN :
I) VERDADERO
Los enlaces iónicos más característicos se produce entre:
Metales (IA y IIA): de baja energía de ionización.
No metales (VIA y VIIA): de alta afinidad electrónica.
II) FALSO
Los compuesto iónicos son duros pero además frágiles, por lo que no son maleables.
III) VERDADERO
Todos los compuestos iónicos son sólidos y cristalinos , formados por una red inmensa de iones con cargas opuestas, no forman moléculas .
Rpta. : "D"
EJERCICIO 17 :
El enlace iónico se presenta entre iones de carga opuesta que se han formado debido a una transferencia de electrones.
Al respecto, indique la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F):
I) Se forma entre un metal de alta energía de ionización y un no metal de baja afinidad electrónica.
II) Por lo general se forma entre un metal del grupo 1 y 2 con un no metal del grupo 16 y 17 de la tabla periódica.
III) La transferencia de electrones se produce desde el no metal hacia el metal.
A) FVF
B) VFF
C) FVV
D) VVF
E) VVV
RESOLUCIÓN :
El enlace iónico se establece principalmente entre un metal (baja energía de ionización y baja electronegatividad) y un no metal (alta electrónica y alta electronegatividad).
El metal pierde electrones y el no metal gana electrones.
Los iones formados se mantienen unidos mediante la fuerza electrostática.
I) Generalmente se forma entre un metal de baja energía de ionización y un no metal de alta afinidad electrónica. Todo lo contrario a la proposición I, por lo tanto es falso (F).
II) Generalmente se forma fácilmente con los metales del grupo 1 (IA), 2 (IIA) con los no metales del grupo 16 (VIA) y 17 (VIIA), por lo tanto es verdadero (V).
III) La transferencia de electrones se da desde el metal (electropositivo) hacia el no metal (electronegativo) por lo tanto es falso (F)
Rpta. : "A"
EJERCICIO 18 :
En la estructura de Lewis del ion poliatómico, la hibridación del nitrógeno es ...(i)..., la del carbono ubicado a la izquierda es ...(ii)... y la del carbono ubicado a la derecha es ...(iii)... .
RESOLUCIÓN :
Rpta. : "C"
PRACTICA
PREGUNTA 1 :
¿Cuántos electrones de valencia posee el compuesto: HNO3?
A) 24
B) 26
C) 28
D) 30
E) 32
PREGUNTA 2 :
Un elemento del cuarto periodo posee la notación de Lewis Indique su número atómico.
A) 18
B) 36
C) 54
D) 56
E) 84
PREGUNTA 3 :
En los siguientes compuestos iónicos determina respectivamente el número de electrones transferidos.
I) MgO
II) KCℓ
III) CaF2
A) 2, 1, 1
B) 1, 1, 2
C) 3, 2, 1
D) 2, 1, 2
E) 2, 2, 2
PREGUNTA 4 :
¿Cuántos elementos de valencia si n enlaces se presentan en el compuesto H2SiO3?
A) 10
B) 12
C) 14
D) 16
E) 18
PREGUNTA 5 :
¿Qué tipo de enlace entre los átomos que forman al compuesto Na2O?
EN(O)=3,5
EN(Na)=0,8
A) iónico
B) covalente
C) dativo
D) dipolo
E) puente de hidrógeno
PREGUNTA 6 :
Un elemento químico A del grupo VIA se une a un elemento químico B del grupo V.A.
¿Qué compuesto se forma?
A) A3B
B) A5B6
C) A2B3
D) A3B2
E) A6B5
PREGUNTA 7 :
Marca la alternativa correcta
A→CO2
B→Cℓ2O
A) A tiene más enlaces sigma que B.
B) A tiene igual enlaces sigma que B.
C) A tiene menos enlaces de oxígeno que B.
D) No debo utilizar esta alternativa.
PREGUNTA 8 :
¿Cuál(es) de las especies químicas que se dan a continuación no presentan resonancia:?
I) HCℓ O
II) N2O4
III) H2Se
A) sólo II
B) sólo I
C) sólo III
D) I y II
E) I y III
PREGUNTA 9 :
¿qué compuesto es esencialmente covalente?
A) LiNO3
B) HCℓO4
C) Ag(NO3)
D) Na(OH)
E) BaS
PREGUNTA 10 :
Determina el número de electrones enlazantes y no enlazantes en: E2F2
Sabiendo que el elemento “E” tiene en total 2 electrones desapareados 2 orbitales menos
A) 10 y 10
B) 6 y 12
C) 10 y 12
D) 4 y 12
E) 8 y 12
PREGUNTA 11 :
¿Qué enlace presenta mayor carácter covalente?
A) H – F
B) C – C
C) O – F
D) S – H
E) H – N
PREGUNTA 12 :
De las proposiciones dadas:
☛ Los compuestos electrovalentes o iónicos no se comportan como electrolitos.
☛ El agua es un buen conductor de la electricidad ya que se presenta dos enlaces heteropolares.
☛ Dos enlaces se unen con enlace iónico si la diferencia de sus electronegatividades es mayor que 1,7.
☛ Si la diferencia de electronegatividad entre dos átomos es como entonces estos se unen con enlace covalente polar.
A) 0
B) 1
C) 2
D) 3
E) 4
PREGUNTA 13 :
Enlace se produce por una _____ de electrones y el enlace iónico por una _____ de electrones.
A) transferencia - compartición
B) transferencia aparente - compartición
C) compartición - transferencia
D) compartición aparente - compartición
E) transferencia aparente – compartición aparente
PREGUNTA 14 :
Para los siguientes compuestos indique la veracidad.
A→CH4
B→C3H8
A) A tiene igual enlace sigma que B
B) A tiene menor enlace sigma que B.
C) A tiene enlace Pi más que B.
D) A tiene enlace Pi igual que B.
PREGUNTA 15 :
Diga cuántos enlaces dativos tiene la molécula del ozono:
A) 0
B) 1
C) 2
D) 3
E) 4
PREGUNTA 16 :
Subraya la proposición incorrecta:
A) En los enlaces químicos los átomos tienden a una configuración electrónica estable.
B) En los enlaces los átomos llegan a tener 0 electrones en su última capa (octeto de Lewis)
C) El hidrógeno necesita solo dos electrones para estabilizarse y cumple con la regla del dos.
D) El agua tiene moléculas polares.
E) El metano tiene moléculas polares.
PREGUNTA 17 :
De las moléculas dadas diga cuántas tienen enlaces covalentes polares y cuántos enlaces covalentes apolares:
☛ O3
☛ NH3
☛ H2O
☛ NH2CH3
☛ CH4
☛ N2
A) 3, 3
B) 4, 2
C) 5, 1
D) 12, 4
E) 1, 3
PREGUNTA 18 :
Diga que pareja es incorrecta:
A) Metal alcalino : un electrón de valencia.
B) Halógeno: siente electrones de valencia.
C) Boroide : tres electrones de valencia.
D) Anfígeno : cinco electrones de valencia.
E) Alcalino – térreo : dos electrones de valencia.
PREGUNTA 19 :
Marca verdadero V o falso F según corresponda:
( ) El ángulo de enlace en la molécula del agua es 104°30'
( )Los enlaces iónicos se forman siempre entre un metal y un no metal.
( ) Los compuestos iónicos presentan elevados puntos de fusión.
( ) El O2 tiene moléculas con un enlace triple.
A) VFVF
B) VFVV
C) VVFF
D) FFVV
E) VFFV
PREGUNTA 20 :
Para los compuestos siguientes
A→HCℓ
B→O2
A) A es más covalente que B.
B) A es igual enlace covalente que B.
C) A es menos covalente que B.
D) A es iónico y B covalente
E) A es covalente y B iónico.
PRACTICA PROPUESTA
PROBLEMA 1 :
El Iodo (I2) es un sólido no metálico de color púrpura-negro. Se emplea para obtener el yoduro de potasio (KI), un compuesto químico utilizado como medicamento y suplemento dietético.
Con respecto a estas sustancias, señale la secuencia correcta de verdad (V o F).
I) El KI presenta enlace iónico debido a la compartición de pares de electrones.
II) El I2 es una molécula apolar, y entre sus moléculas presentan fuerzas de London.
III) El KI es un sólido cristalino, que al disolverse en agua conduce la corriente eléctrica.
A) FFV
B) FVV
C) VVF
D) VVV
E) VFV
Rpta. : "B"
PROBLEMA 2 :
Los oligoelementos (iones metálicos denominados minerales) mantienen el equilibrio hídrico y enzimático al ser parte estructural de nuestras células, por lo que el ser humano los necesita para mantener su equilibrio y buen estado de salud. Estos iones están contenidos en compuestos como cloruro de sodio (NaCℓ), sulfato cúprico (CuSO4), carbonato de calcio (CaCO3), entre otros. Con respecto a los compuestos mencionados, indique el valor de verdad (V o F) para las siguientes proposiciones.
I) Su estado natural es sólido y son solubles en solventes apolares.
II) Sus iones se unen por la fuerte atracción electrostática entre catión-anión.
III) Disueltos en sangre o citoplasma conducen la corriente eléctrica.
A) VVF
B) VFV
C) FVV
D) FVF
E) FFF
Rpta. : "C"
PROBLEMA 3 :
En la construcción de viviendas se emplea la piedra chancada o granito. Después de un tratamiento térmico al material, éste se descompone en óxidos como:
SiO2 , Aℓ2O3, CaO, Fe2O3, Na2O, K2O, MgO, la mayoría de estos compuestos tienen enlace iónico. Con respecto a las características de los compuestos iónicos, indique el valor de verdad (V o F) de las siguientes proposiciones:
I) Son sólidos a temperatura ambiente y poseen red cristalina.
II) Sus puntos de fusión y ebullición son generalmente bajos.
III) Fundidos o en solución son buenos conductores de la electricidad.
A) VVV
B) VFV
C) FFF
D) FFV
E) FVV
Rpta. : "B"
PROBLEMA 4 :
Los orfebres pre-hispánicos del antiguo Perú, elaboraron verdaderas joyas de arte con metales como el oro, la plata y el cobre. Estas obras de arte se encuentran en museos nacionales, extranjeros o han sido saqueados, destruidos o fundidos por personas inescrupulosas que no valoran la cultura peruana.
Seleccione la alternativa que contiene las propiedades correctas de los metales mencionados.
A) Presentan dificultad para conducir la electricidad.
B) Poseen baja densidad y brillo metálico.
C) No formar aleaciones entre dichos elementos.
D) Poseen maleabilidad y ductilidad.
E) Forman aleaciones entre dichos elementos.
Rpta. : "D"
PROBLEMA 5 :
La Tabla Periódica presenta 118 elementos químicos. Los átomos de estos elementos se enlazan o unen formando toda la materia de la cual estamos hechos y que nos rodea. Consumimos una variedad de alimentos, fabricamos utensilios diversos para satisfacer nuestras necesidades. Si analizamos desde un punto de vista estructural, científico; seleccione la secuencia correcta de verdad (V o F) de las siguientes afirmaciones:
I) En la sal de mesa que contiene cloruro de sodio (NaCl), el compuesto posee enlace covalente.
II) En la sacarosa (C12H22O11), el enlace entre los átomos de C, H y O es covalente.
III) En el cable de cobre (Cu) que transporta la corriente eléctrica, sus átomos tienen enlace metálico.
A) VVV
B) VVF
C) VFF
D) FVV
E) FFF
Rpta. : "D"
PROBLEMA 6 :
La metilamina, compuesto orgánico de fórmula CH3NH2, es un gas incoloro derivado del amoníaco, donde un átomo de hidrógeno (H) se reemplaza por un grupo metilo (CH3–). Entre las sustancias de interés comercial obtenidas a partir de metilamina encontramos los fármacos efedrina y teofilina.
Con respecto a esta molécula, señale la alternativa correcta.
A) La molécula cumple la regla del octeto.
B) Tiene en total seis pares de electrones enlazantes.
C) Presenta dos pares de electrones libres.
D) Todos los enlaces son polares y la molécula es apolar.
E) El nitrógeno presenta un enlace doble.
Rpta. : "B"
PROBLEMA 7 :
Los gases nobles como el He, Ne y Ar se emplean en diversas industrias, como aeroespacial, de refrigeración y de soldaduras en atmosfera inerte, respectivamente, mientras que el gas amoníaco (NH3), el nitrógeno líquido (N2) y el hielo seco (CO2) se emplean para sistemas de bajas temperaturas. Por otro lado, en la naturaleza cuando la temperatura desciende se genera el granizo y la nieve. Con respecto a las sustancias mencionadas, indique el valor de verdad (V o F) de las siguientes proposiciones:
I) En los gases nobles, en el nitrógeno, en el amoníaco y en el hielo seco están presentes sólo las fuerzas de London.
II) Las fuerzas débiles de atracción entre las moléculas del hielo seco permiten su sublimación a temperatura ambiente.
III) En el granizo y la nieve conformados por moléculas de agua al estado sólido predominan las fuerzas dipolo-dipolo.
A) VVV
B) VVF
C) FFV
D) FVF
E) FFF
Rpta. : "D"
PROBLEMA 8 :
Las fuerzas de dispersión de London son un tipo de fuerza intermolecular, denominadas así por el físico alemán Fritz London, quien las investigó en 1930. Surgen entre moléculas no polares (apolares) como en moléculas polares. En las apolares aparecen los dipolos instantáneos. Son más intensas cuanto mayor es la masa molar de la molécula, ya que los dipolos se pueden producir con más facilidad. Seleccione la alternativa que contiene una sustancia cuyas moléculas son polares.
A) PH3
B) BeCℓ2
C) SF6
D) BCl3
E) CO2
Rpta. : "A"
PROBLEMA 9 :
El monóxido de carbono (CO) y el dióxido de carbono, CO2, son producidos al quemar diversos combustibles fósiles, en tanto que los cianuros, CN1– están distribuidos en el reino vegetal como en el caso de los glucósidos cianogenéticos (almendras), por otro lado, el acetileno (C2H2) se emplea en soldadura autógena. Con respecto a las especies mencionados seleccione aquella que contiene un enlace múltiple y dos enlaces simples a la vez.
A) CO
B) CO2
C) CN–
D) C2H2
E) CO3
Rpta. : "D"
PROBLEMA 10 :
Las propiedades de las sustancias se determinan en gran medida por los enlaces químicos que mantienen unidos a sus átomos. El enlace químico consiste de una fuerte interacción entre átomos iguales o diferentes que permite la formación de sustancias más estables.
Al respecto, seleccione la secuencia correcta de verdad (V o F).
I) El hidrógeno (H2), el oxígeno (O2), el amoniaco (NH3) y el metano (CH4) son moléculas donde sus átomos se unen por enlace covalente.
II) Los minerales silvita (KCℓ) y periclasa (MgO) presentan enlace iónico y altos de puntos de fusión.
III) El oro (Au) y el cloruro de berilio (BeCℓ2) presentan enlace metálico y iónico, respectivamente.
A) VVV
B) VVF
C) FVF
D) VFV
E) VFF
Rpta. : "B"
PROBLEMA 11 :
La intensidad de las fuerzas intermoleculares es muy pequeña en comparación con la intensidad de los enlaces químicos (metálico, iónico y covalente). Seleccione la alternativa que establezca la correspondencia entre sustancia y tipo de fuerza intermolecular predominante.
a) Sulfuro de hidrogeno (H2S)
b) Dióxido de carbono (CO2)
c) Fluoruro de hidrógeno (HF)
( ) Fuerzas de London
( ) Puente de hidrógeno
( ) Dipolo – dipolo
A) bca
B) abc
C) bac
D) cba
E) acb
Rpta. : "A"
PROBLEMA 12 :
Durante el Virreinato del Perú, se explotaba el azogue; hoy conocido como mercurio (Hg); en las minas de Huancavelica, pero fue cerrada debido a las incontables muertes producidas en su interior. Por otro lado, actualmente la compañía minera Buenaventura cuenta con la mayor producción de minerales de plata (Ag). Tanto la plata como el mercurio son apreciados, sin embargo, dada la toxicidad de este último, su uso está restringido. En cambio, la plata se sigue utilizando en monedas, filigranas y joyas.
Al respecto, seleccione la alternativa con la secuencia correcta de verdad (V o F).
l) Ambos presentan brillo metálico y son buenos conductores de la electricidad.
II) Poseen puntos de fusión variable, desde muy bajos hasta muy altos.
III) En las filigranas (hilos) de plata, se aprovecha la propiedad de maleabilidad.
A) VVV
B) FFV
C) FVF
D) VFV
E) VVF
Rpta. : "E"
PROBLEMA 13 :
Los científicos buscan descubrir la estructura interna de la materia, para poder aplicar estos conocimientos a la solución de problemas que existen en la naturaleza, como por ejemplo conocer la estructura del ozono y con ello entender su conversión en la estratósfera. Para interpretar la naturaleza de la formación de enlace entre los átomos se establece la regla del octeto. Indique la relación correcta entre las moléculas y su relación con la regla de octeto.
I) Trifluoruro de boro (BF3)
II) Hexafluoruro de azufre (SF6)
III) Ozono (O3)
IV) Tricloruro de fósforo (PCℓ3)
(a) cumple la regla del octeto
(b) incumple la regla de octeto por exceso
(c) incumple la regla de octeto por defecto
A) Ic, IIb, IIIa
B) Ib, IIc, IVa
C) IIc, IIIa, IVa
D) Ia, IIb, IVc
E) Ib, IIb, IVb
Rpta. : "A"
PROBLEMA 14 :
Las fuerzas intermoleculares están presentes en sustancias con enlace covalente y pueden presentarse en estado gaseoso, líquido o sólido. El gas ozono (O3), nos protege de la radiación UV. El agua (H2O), es un líquido fundamental para sostener la vida en el planeta. El bromo (Br2) otro líquido que es muy toxico para los seres vivos. El yodo (I2) es un sólido que sublima a baja temperatura y de mayor tamaño que el bromo (Br2).
Al respecto seleccione la alternativa incorrecta.
A) El ozono presenta entre sus moléculas interacción dipolo – dipolo.
B) Las moléculas del agua presentan entre ellas puente de hidrógeno.
C) El yodo presenta entre sus moléculas sólo fuerzas de dispersión de London.
D) El bromo presenta menor punto de ebullición con respecto al yodo.
E) En el ozono y en el agua predominan las fuerzas intermoleculares de tipo London.
Rpta. : "A"
PROBLEMA 15 :
El ácido muriático es la solución impura del cloruro de hidrógeno [HCℓ(g)], contiene aproximadamente un 28% de este compuesto. Este ácido se emplea para realizar la limpieza de los inodoros en los hogares. Seleccione la alternativa que contiene la clasificación del tipo de enlace que une al H y Cℓ en el cloruro de hidrógeno.
Dato: EN: H = 2,1; Cℓ= 3,0
A) no coordinado – polar – doble
B) dativo – apolar – simple
C) no coordinado – polar – simple
D) dativo – apolar – triple
E) dativo – anular – triple
Rpta. : "C"
PROBLEMA 16 :
El sodio (11Na) y el cloro (17Cℓ) se unen formando cloruro de sodio (NaCℓ). Esta sal se encuentra en los salares de Maras (Cusco) en estado sólido, se encuentra disociado en los océanos. Para consumo humano se añade sales de yodo, para prevenir la enfermedad del bocio.
Con respecto a las características del enlace químico y a las propiedades del compuesto, seleccione la alternativa incorrecta.
A) De acuerdo a su ubicación en la Tabla Periódica, el sodio presenta baja energía de ionización y el cloro presenta alta electronegatividad.
B) Los átomos de ambos elementos adquieren la configuración de gas noble luego de la transferencia del electrón de valencia del sodio.
C) El cloruro de sodio presente en la sal de Maras, forma una red cristalina al estado sólido y como tal, es un buen conductor de la electricidad.
D) En los océanos del mundo, el compuesto se encuentra como iones sodio (Na1+) y iones cloruro (Cℓ1–).
E) A condiciones ambientales, el NaCl se encuentra en estado sólido y tiene alta temperatura de fusión.
Rpta. : "C"
¿PORQUÉ ALGUNAS SUSTANCIAS SE COMPONEN DE IONES Y OTRAS DE MOLÉCULAS?
Las clases para contestar esta pregunta se encuentran en las estructuras electrónicas de los átomos en cuestión y en la naturaleza de las fuerzas químicas dentro de los compuestos.
En este capítulo siguiente examinaremos las relaciones entre estructura electrónica, fuerzas de enlace químico y propiedades de la sustancia.
ENLACE COVALENTE
Los químicos norteamericanos Lewis y Langmuir utilizaron la regla del octeto no solo para explicar la formación de com-puestos iónicos, sino también los no iónicos. Según Lewis, dos átomos de un enlace pueden cumplir con la regla del octeto, no solo al trasladar electrones, sino también al compartir una o más parejas de electrones. En este caso, se considera que el par o pares de electrones compartidos pertenecen a la periferia de ambos átomos.
ENLACES COVALENTES MÚLTIPLES
Resultados experimentales sumados a la idea de que cada átomo, en una molécula, ha de tener configuración de un gas noble, ponen en evidencia la existencia de enlaces covalentes por compartición de 2 ó 3 pares de electrones.
ENLACE COVALENTE COORDINADO O DATIVO
El enlace coordinado es un tipo de enlace covalente. En este tipo de enlace, a diferencia de los anteriores (iónico y covalente normal) un solo átomo es el que aporta el par de electrones necesarios para formar el enlace. Según los valores de electronegatividad de los átomos que intervienen, los enlaces covalentes pueden ser de dos tipos:
1) ENLACE COVALENTE APOLAR
Se forma entre átomos iguales o entre átomos diferentes, siempre y cuando la diferencia de electronegatividad sea cero o muy pequeña (menor que 0,5). En este tipo de enlace los electrones son atraídos con la misma intensidad, formando moléculas apolares cuya nube electrónica es uniforme.
2) ENLACE COVALENTE POLAR
Se da entre átomos de elementos diferentes y, como regla, la diferencia de electronegatividad debe ser menor de 1,7 y mayor que 0,5. En este enlace los átomos enlazados tienen diferente electronegatividad, entonces uno de ellos (el de mayor electronegatividad) atrae con mayor intensidad a los electrones compartidos.
ENLACE COVALENTE POLIATÓMICO
Aunque la regla del octeto y las estructuras de Lewis no dan una visión completa del enlace covalente, son de gran utilidad para representar los enlaces de muchos compuestos y explicar las propiedades y reacciones de las moléculas.
Por esta razón, es conveniente practicar la escritura de las estructuras de Lewis de los compuestos que poseen varios átomos en su estructura.
Debemos considerar siempre que en el diagrama Lewis se elije generalmente un átomo central y también se busca la simetría de la molécula.