MODELOS ATÓMICOS EJERCICIOS RESUELTOS PDF
PREGUNTA 1 :
Respecto a los modelos atómicos, indique la proposición correcta:
A) El modelo de Rutherford explicó claramente la estabilidad del átomo.
B) Uno de los postulados del modelo de Bohr es que el momento angular de un electrón, en una órbita determinada, está cuantizado.
C) El modelo mecánico cuántico del átomo es absolutamente determinista y no probabilístico.
D) J. Dalton consideró que los isótopos tienen distinto número de neutrones.
E) El experimento de rayos catódicos de Thomson determinó directamente la masa de los electrones.
RESOLUCIÓN :
a. Incorrecta
Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, ubicado en el centro del átomo. Pero no pudo explicar cómo los electrones no caerían en el núcleo por pérdida de energía.
b. Correcta
Postulados de N. Borh
• El electrón describe órbitas circulares en torno al núcleo, debido a la fuerza eléctrica.
• Solo están permitidas aquellas órbitas en las cuales el momento angular es un múltiplo entero.
• El átomo puede emitir o absorber un fotón de radiación electromagnética mediante la transición del electrón de una órbita a otra, de forma que se conserve la energía total. Cuando el electrón pasa de una órbita de mayor a menor energía, emite un fotón.
c. Incorrecta
El modelo mecánico cuántico era un modelo probabilista que permitía hacer predicciones empíricas, pero en el que la posición y la cantidad de movimiento no pueden conocerse simultáneamente, por el principio de incertidumbre.
d. Incorrecta
Según el modelo atómico de J. Dalton, la materia ordinaria está formada por partículas muy pequeñas llamadas átomos, que son invisibles y no se pueden crear ni destruir. Para ese entonces no se conocían los neutrones.
e. Incorrecta
Los experimentos de J. J. Thomson con tubos de rayos catódicos mostraron que todos los átomos contienen pequeñas partículas subatómicas con carga negativa, llamadas electrones. Fue el físico estadounidense Robert Andrews Millikan, quien pudo determinar la masa del electrón.
Rpta. : "B"
PREGUNTA 2 :
La alternativa, cuyo enunciado no corresponde a la teoría atómica de Dalton, es:
A) El átomo es indivisible e indestructible.
B) Los átomos de un mismo elemento tienen las mismas propiedades.
C) Los átomos de elementos diferentes tienen diferentes propiedades.
D) Los átomos de elementos diferentes al combinarse forman un compuesto.
E) Los átomos de un mismo elemento pueden tener diferente masa.
RESOLUCIÓN :
Postulados de la teoría atómica de Dalton (1805):
I. La materia posee átomos que son indivisibles e indestructibles.
II. Los átomos de un mismo elemento tienen las mismas propiedades (masa).
III. Los átomos de elementos diferentes tienen propiedades diferentes.
IV. Los átomos de elementos distintos al combinarse forman un compuesto.
Rpta. : "E"
PREGUNTA 3 :
Desde tiempos ancestrales el ser humano ha examinado la naturaleza de la materia, llegando a establecer que está formada por átomos, moléculas e iones. Las ideas modernas acerca de la estructura de la materia comenzaron a tomar forma con Jhon Dalton a principios del siglo XIX, desde entonces, los modelos acerca del átomo han ido evolucionando hasta llegar al modelo actual, en el cual se plantea un modelo matemático basado en la ecuación de Schrödinger (modelo cuántico). Al respecto marque la alternativa INCORRECTA.
A) Según Bohr, los electrones de acuerdo a su energía giran en orbitas definidas alrededor del núcleo.
B) El modelo mecánico cuántico introduce el concepto de orbital o región de máxima probabilidad.
C) Según Dalton, los átomos del mismo elemento tiene igual masa y no considera el concepto de isótopos.
D) Según Thomson, el átomo se considera como una esfera de carga negativa con los protones incrustados en su interior.
E) En el modelo de Rutherford, el átomo consta de un núcleo rodeado de electrones (modelo planetario).
RESOLUCIÓN :
A) VERDADERO
Según Bohr los electrones de acuerdo a su energía giran en orbitas definidas dentro del átomo.
B) VERDADERO
El modelo mecánico cuántico introduce el concepto de orbital o región de máxima probabilidad. Establece tres números cuánticos para definir un orbital.
C) VERDADERO
Según Dalton los átomos del mismo elemento tiene igual masa y no considera el concepto de isótopos.
D) FALSO
Según Thomson establece que las cargas negativas están incrustadas en una masa de carga positiva.
E) VERDADERO
En el modelo de Rutherford el átomo consta de un núcleo rodeado de electrones, motivo por el cual a este modelo se le conoció como “modelo planetario”.
Rpta. : "D"
PREGUNTA 4 :
De la experiencia de Ernest Rutherford , se dedujo lo siguiente :
A) La zona extranuclear tiene gran densidad.
B) Rutherford explicó los espectros continuos.
C) Los electrones poseen una masa muy pequeña.
D) Las partículas alfa son muy pesadas.
E) El núcleo átomo tiene una densidad muy alta.
RESOLUCIÓN :
Experiencia de Rutherford : En 1911 desarrollo su histórico experimento de la lámina de oro , donde bombardeo con partículas alfa una lámina de oro delgadísima (2000 átomos de espesor), descubriendo el núcleo atómico , concluyo :
* El átomo es casi vacío.
* Su masa se concentra en el núcleo atómico el cual es muy pequeño (alta densidad).
* Los electrones giran alrededor del núcleo en órbitas circulares.
* El átomo se asemejan al sistema solar.
Rpta. : "E"
PREGUNTA 5 :
Respecto a la estructura interna de la materia, a través de la historia se plantearon diferentes concepciones filosóficas y modelos atómicos para poder explicar las propiedades del mundo material que nos rodea. Estos fueron evolucionando hasta llegar al modelo actual, el cual es un modelo matemático basado en la ecuación de Schrödinger.
Considerando los modelos atómicos, marque la alternativa que contiene la secuencia correcta de verdad (V) o falsedad de las siguientes proposiciones
I) El modelo mecánico cuántico del átomo establece el concepto de orbital
II) En el modelo de Rutherford, el átomo está formado por núcleo y la corteza electrónica.
III) Según Thomsom los electrones se encuentran fuera del núcleo y pegados a éste.
IV) Según Bohr los electrones, de acuerdo a su energía están girando en orbitas permitidas.
A) FFFF
B) FFVV
C) FVVV
D) VVFV
E) VFFV
RESOLUCIÓN :
I) VERDADERO
El modelo mecánico cuántico del átomo se basa en la ecuación de Schrödinger, la cual al resolverse conduce a funciones que se relacionan con parámetros conocidos como los números cuánticos. Este modelo establece el concepto de orbital.
II) VERDADERO
En el modelo de Rutherford, el átomo está formado por núcleo pequeño y concentrado en masa y la corteza electrónica de gran volumen.
III) FALSO
Según Thomsom, el átomo es una esfera positiva en cuyo interior se encuentran las partículas negativas o electrones que lo neutralizan.
IV) VERDADERO
Según Bohr los electrones, de acuerdo a su energía, están girando en orbitas o niveles permitidos.
Rpta. : "D"
PREGUNTA 6 :
Con respecto a la teoría atómica de Bohr , es incorrecto :
A) En un átomo hay interacción eléctrica entre su núcleo positivo y el electrón que gira a su alrededor.
B) En los saltos electrónicos se emite o absorben valores específicos de energía.
C) Este modelo no se puede aplicar al Calcio.
D) Los radios de las órbitas circulares no pueden asumir cualquier valor.
E) Explica el efecto Zeeman, que es el desdoblamiento de las líneas espectrales por acción de un campo magnético externo.
RESOLUCIÓN :
El modelo atómico de Niels Bohr, se limita para especies que tiene un solo electrón especialmente para el átomo de Hidrógeno (1H).
Postulados :
1) El electrón gira circularmente en torno al núcleo.
2) El radio de giro del electrón está cuantizada.
3) La energía del electrón es constante en cada órbita.
4) El electrón realiza saltos electrónicos al emitir o al absorber energía.
La líneas finas observadas por Sommerfeld fueron obtenidas cuando el átomo fue puesto bajo la acción del campo magnético externo indicando la existencia de los subniveles.
Rpta. : "C"
PREGUNTA 7 :
Indique las proposiciones verdaderas referente al espectro del hidrógeno atómico
I) El espectro de emisión contiene más líneas que el de absorción .
II) Las 3 series de las líneas espectrales más reconocidas del espectro son Lyman , Balmer y Pfund
III) El espectro de emisión y absorción del átomo solo se diferencian en la forma de excitar al átomo.
A) I
B) II
C) III
D) I,II
E) I,II,III
RESOLUCIÓN :
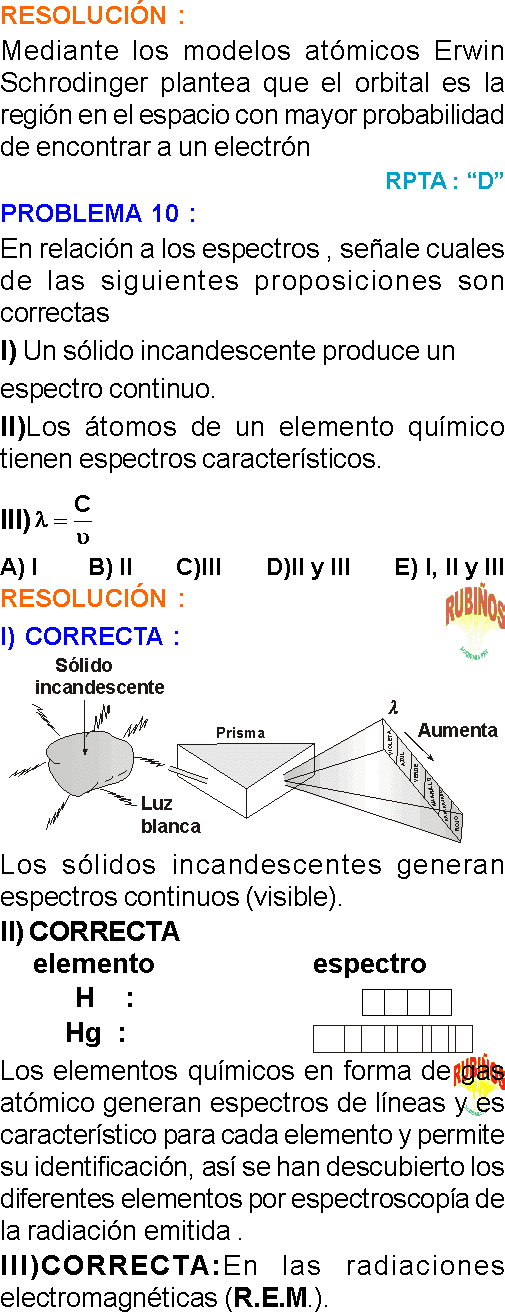
Respecto al espectro atómico del hidrógeno
I) VERDADERA
A las condiciones del experimento (25°C y 1 atm), el número de líneas brillantes (de emisión) es mucho mayor que el número de líneas negras (de absorción).
II) FALSA
Las 3 líneas espectrales más reconocidas son Las que pertenecen a la región espectral ultravioleta , visible e infrarroja cercana; osea , serie de Lyman , Balmer y Paschen , respectivamente .
III) FALSA
El espectro de emisión está formado por líneas brillantes y es generado por un átomo excitado mediante descarga eléctrica .
El espectro de absorción está formado por líneas oscuras o negras y es generado por un átomo excitado debido a la acción de la luz en fase gaseosa.
Rpta. : "A"
PREGUNTA 8 :
Según el modelo atómico de Thomson no se cumple
A) El átomo se asemeja a un «Budín con pasas»
B) Determina la relación carga - masa del electrón
C) El átomo es de naturaleza positiva y lleva incrustados a los electrones.
D) Eléctricamente el átomo es neutro .
E) El átomo posee un núcleo cargado positivamente , rodeado de cargas negativas.
RESOLUCIÓN :
No se cumple la proposición E , porque en el modelo atómico de Thomson , no se plantea la presencia de un núcleo .
Rpta. : "E"
PREGUNTA 9 :
Con respecto al modelo atómico de Bohr par el átomo de hidrógeno, indique, ¿Cuál de las siguientes afirmaciones no es correcta?:
A) Sólo determinados valores de energía pueden hacer pasar un electrón de un órbita a otra.
B) Los radios de las órbitas circulares pueden tener un valor cualquiera.
C) Cuando un electrón salta de una órbita mayor a una menor, libera energía.
D) El modelo de Bohr no se puede aplicar al átomo de Uranio.
E) El modelo de Bohr logra dar una explicación de las líneas espectrales del hidrógeno.
RESOLUCIÓN :
Según Bohr, los radios de las orbitales circulares o radios de giro son valores cuantificados, dados por rn=n2×53 pm
Rpta. : "B"
PREGUNTA 10 :
¿Qué proposiciones no es una característica del modelo atómico de Rutherford? .
A) Se asemeja a un sistema planetario en miniatura.
B) Los electrones giran alrededor del núcleo en órbitas circulares .
C) Posee un núcleo cargado positivamente y de alta densidad
D) La energía de un electrón en un orbital es constante
E) La masa del átomo se concentra en el núcleon.
RESOLUCIÓN :
No se cumple la proposición D, porque el modelo atómico de Rutherford no se propone la presencia de órbitas .
Rpta. : "D"
PREGUNTA 11 :
Con respecto al modelo atómico de Bohr indique cuál de las siguientes proposiciones es incorrecta:
A) Fue desarrollado para el átomo de hidrógeno
B) Introdujo el concepto de niveles discretos de energía.
C) Explica el modelo de H2
D) Llega a la misma expresión matemática que Rydberg con respecto al espectro del hidrógeno.
E) Asume orbitas circulares para el movimiento del electrón.
RESOLUCIÓN :
A) VERDADERO
El modelo de Bohr se desarrolló para el átomo de «H» (posee 1e– ).
B) VERDADERO
En el átomo de Bohr el e– se mueve en niveles estacionarios de energía (constante).
C) FALSO
El modelo de Bohr solo explica propiedades atómicas del «H».
D) VERDADERO
Al igual que Rydberg explica los espectros atómicos del «H».
E) VERDADERO
Las órbitas del e– en el átomo de «H» son circulares.
Rpta. : "C"
PREGUNTA 12 :
Indique la proposición falsa en los hechos de la teoría atómica de Dalton.
A) Los elementos químicos consisten de partículas muy pequeñas llamadas átomos, porción hasta la cual el elemento conserva sus propiedades particulares .
B) Hay tantas clases químicamente distintas de átomos, como elementos existen.
C) En un elemento, sus átomos son diferentes.
D) Los compuestos están formados por la combinación de átomos de elementos diferentes.
E) Los átomos permanecen invisibles en las reacciones químicas, en las cuales sólo intervienen números enteros de átomos.
RESOLUCIÓN :
Según Dalton : átomos iguales pertenecen a un mismo elemento, luego átomos diferentes pertenecen a diferentes elementos. Este concepto en la actualidad ha sido superado, con el concepto sobre los isótopos.
Rpta. : "C"
PREGUNTA 13 :
Indique, ¿Cuál de las siguientes afirmaciones es falsa, con respecto al modelo atómico de Bohr?.
A) Cada orbita electrónica tiene una energía característica.
B) En el modelo atómico de Bohr la energía está cuantizada.
C) Cuando un electrón cae de una orbita más alejada del núcleo a otra más cercana, absorbe un fotón.
D) El núcleo del átomo es positivo e interactúa electrostáticamente con el electrón que gira a su alrededor.
E) Cuando un electrón salta de una orbita a otra, se absorbe o desprende energía.
RESOLUCIÓN :
En el modelo atómico de Bohr: un electrón EMITE un fotón cuando pasa de un nivel más alejado del núcleo (de mayor energía) a otro más cercano (de menor energía).
Rpta. : "C"
PREGUNTA 14 :
De las siguientes consideraciones sobre el modelo atómico de Bohr , indique aquella que es incorrecta.
A) El electrón gira del núcleo en estados estacionarios de energía, es decir en órbitas de energía definida.
B) El electrón gira alrededor del núcleo en orbitas elípticas.
C) Mientras el electrón esté en un estado estacionario no emite ni absorbe energía.
D) Cuando el electrón absorbe energía asciende a un nivel de energía superior , constituyendo un estado excitado.
E) Un electrón emitirá determinada cantidad de energía cuando regrese del estado excitado a su nivel original.
RESOLUCIÓN :
Según Bohr el electrón gira alrededor del núcleo en órbitas circulares , sin ganar ni perder energía con una cierta velocidad dependiente del radio de giro con una energía cuantificada , luego se nombran como niveles estacionarios.
Rpta. : "B"
PREGUNTA 15 :
Respecto al modelo atómico de Bohr indique la proporción verdadera (V) o falsa (F) según corresponda:
I) Este modelo es válido solo para el hidrógeno o especies isoelectrónicas del hidrógeno.
II) Demuestra la estabilidad de la órbita electrónica en el átomo de hidrógeno.
III) El electrón en el átomo de hidrógeno posee energía fija y definida en cada estado estacionario.
A) VVV
B) VVF
C) VFF
D) VFV
E) FVF
RESOLUCIÓN :
Del modelo atómico de Bohr :
I) VERDADERO
Este modelo es válido sólo para el átomo de hidrógeno y especies isoelectrónicas (hidrógeno de un sólo e –
II) VERDADERO
Los electrones se mueven en órbitas permitidas (estables) de radio definido.
III) VERDADERO
Las órbitas electrónicas son niveles estacionarios de energía (energía constante).
Rpta. : "A"
PREGUNTA 16 :
Respecto a los rayos gamma, ultravioleta y alfa, indique la veracidad (V) o falsedad (F) de las siguientes proposiciones :
I) Todas son ondas electromagnéticas.
II) Se propagan con la misma velocidad en el vacío.
III) Los rayos alfa no se encuentran ubicados en el espectro electromagnético.
A) VVF
B) VFF
C) FVF
D) FVV
E) FFV
RESOLUCIÓN :
Respecto a los rayos gamma , ultravioleta y alfa :
I) FALSO
Las ondas electromagnéticas no poseen carga ni masa, por lo que los rayos γ y UV los son , mientras que las α no.
II) FALSO
Las ondas electromagnéticas viajan en el vacío a 300 000 km/s (velocidad de la luz), las alfa en promedio a 20 000 km/s.
III) VERDADERO
Las emisiones alfa al ser corpusculares(partículas) no están ubicadas en el espectro electromagnético total.
Rpta. : "E"
PREGUNTA 17 :
Señale como verdadera (V) o falsa (F) a las proposiciones siguientes :
I) Un espectroscopio permite visualizar un espectro visible.
II) Un espectrógrafo gráfico o fotografía al espectro visible.
III) Dependiendo de las condiciones experimentales la luz se comporta como onda o como partícula.
A) VFV
B) VVV
C) FFF
D) VFF
E) FVV
RESOLUCIÓN :
I) VERDADERO
El Espectroscopio es un instrumento que se emplea para observar los espectros visibles.
II) VERDADERO
El Espectrógrafo gráfico registra los espectros en láminas fotográficas es decir, fotografía al espectro visible.
III) VERDADERO
La luz presenta comportamiento dual : Onda - Partícula
Rpta. : "B"
PREGUNTA 18 :
Marque la conclusión a la que llegaron Rutherford y sus colaboradores, sobre el modelo atómico después de su comentado experimento del bombardeo de una lámina de oro con partículas a (núcleo de He).
A) Los electrones son partículas de gran masa.
B) Las partes de los átomos cargadas positivamente, son extremadamente pequeñas y pesadas.
C) Las partes cargadas positivamente de los átomos se mueven con una velocidad cercana a la de la luz.
D) El diámetro del electrón es aproximadamente igual a la parte cargada positivamente (núcleo).
E) El peso del electrón es aproximadamente igual al del núcleo.
RESOLUCIÓN :
Rutherford dirigió una serie de experimentos usando hojas delgadas de oro, para que le sirvieran de blancos sobre los cuales se disparaban partículas a. En su mayoría penetraban y pasaban las láminas de oro sin desviación alguna, una minoría, sufrían una desviación y algunas partículas a rebotaban sobre la lámina y regresaban hacia atrás. Esto significa que las cargas positivas del átomo son extremadamente pequeñas y pesadas.
Rpta. : "B"
PREGUNTA 19 :
Con respecto a los espectros de emisión o absorción. ¿Cuáles de las siguientes proposiciones son correctas?
I) El espectro de emisión del hidrógeno está formado por líneas de color sobre fondo negro que se obtienen a partir de los átomos de hidrógeno en estado excitado.
II) La incandescencia de sólido, líquidos y gases a alta presión generan espectros continuos.
III) El espectro visible es el conjunto ordenado de las radiaciones electromagnéticas procedente de la descomposición de una luz por un medio dispersor.
A) VFV
B) FFV
C) FFF
D) VVF
E) VVV
RESOLUCIÓN :
Sobre los espectros de emisión y absorción :
I) VERDADERO
Los espectros de emisión se registran como líneas de colores sobre fondo oscuro debido a saltos de electrones de átomos excitados.
II) VERDADERO
En los estados condenados : sólidos y líquidos así como gases a altas presiones producen espectros continuos (de bandas).
III) VERDADERO
El espectro visible (continuo) , se produce por el paso de la luz blanca por un medio dispersor.
Rpta. : "E"
PREGUNTA 20 :
Indique verdadero (V) o falso (F) según corresponda
I) El espectro de emisión del átomo del hidrógeno , se obtiene cuando este elemento al estado gaseoso y una baja presión x , es excitado al ser sometido a descargas eléctricas.
II) El espectro de absorción del hidrógeno , se obtiene cuando se pasa luz blanca a través del hidrógeno no excitado y luego a través de una rendija de un prisma, al analizar el haz de luz que emerge se observa que solo se absorbió ciertas longitudes de ondas.
III) Para un elemento , las longitudes de onda del espectro de absorción son las mismas que las producidas en la emisión.
IV) Un átomo de cada elemento tiene su propio conjunto de líneas característico en su espectro de emisión de absorción.
A) VVVV
B) VVFV
C) VFVV
D) VVVF
E) FVVV
RESOLUCIÓN :
I) VERDADERO
Para el «H» los espectros de emisión se generan por excitación de una muestra enrarecida usando descargas eléctricas.
II) VERDADERO
Los espectros de absorción se generan empleando luz blanca sobre las «H» no excitado.
III) VERDADERO
Las líneas espectrales de emisión y absorción son coincidentes en posición y λ .
IV) VERDADERO
Cada elemento químico produce espectros característicos y únicos.
Rpta. : "A"
PREGUNTA 21 :
Diga qué expresión es incorrecta :
A) Energía cinética es la energía de un cuerpo que se mueve.
B) Materia es todo aquello que posee masa.
C) La teoría atómica se debe a Dalton.
D) Isótopo es el elemento que tiene el mismo número atómico y la misma masa.
E) La temperatura mide la intensidad calorífica.
RESOLUCIÓN :
Los isótopos son átomos de un mismo elemento con distinto número de neutrones. Presentan igual número atómico; pero diferente número de neutrones.
Rpta. : "D"
PRIMERA PRACTICA
PREGUNTA 1 :
El significado etimológico de la palabra átomo es:
A) indestructible
B)impenetrable
C)duro
D) sin división
E) suave
PREGUNTA 2 :
Propuso que los átomos de un mismo elemento son idénticos en todas sus propiedades.
A) Thomson
B) Rutherford
C) Bohr
D) Dalton
E) De Broglie
PREGUNTA 3 :
Los primeros que pensaron en el "átomo" como la división más pequeña de la materia.
A) Dalton y Rutherford
B) Anaxímenes y Demócrito
C) Empédocles y Aristóteles
D) Leucipo y Demócrito
E) Platón y Descartes
PREGUNTA 4 :
Descubrió los rayos catódicos:
A) Mendeléiev
B) Goldstein
C) Thomson
D) Planck
E) Millikan
PREGUNTA 5 :
Descubrió los neutrones:
A) Chadwick
B) Bohr
C) Rutherford
D) De Broglie
E) Thomson
PREGUNTA 6 :
Estableció la carga del electrón:
A) Rutherford
B) Planck
C) Becquerel
D) Crookes
E) Thomson
PREGUNTA 7 :
En 1895, el alemán Roentgen descubre los rayos _______
A) alfa
B) beta
C) canales
D) catódicos
E) X
PREGUNTA 8 :
El científico que calcula la relación carga-masa del electrón fue:
A) Becquerel
B) Rutherford
C)Thomson
D) Bohr
E) Sommerfeld
PREGUNTA 9 :
Descubre la radiactividad natural:
A) Dalton
B) Rutherford
C) De Broglie
D) Becquerel
E) Pierre Curie
PREGUNTA 10 :
En 1904, J.J. Thomson propone el modelo atómico:
A) sopa con fideos
B) budín de electrones
C) budín con pasas
D) sistema planetario
PREGUNTA 11 :
En 1898, los esposos Curie descubrieron los elementos:
A) sodio y potasio
B) uranio y radio
C) radio y polonio
D) radio y plutonio
E) radio y sodio
PREGUNTA 12 :
El estadounidense Robert Millikan calcula la carga del electrón mediante:
A) el efecto tindall
B) la caída de aceite
C) el experimento de la gota de aceite
D) el efecto Doppler
PREGUNTA 13 :
En 1905, publicó un artículo que relaciona la masa con la energía.
A) Thomson
B) Hahn
C) Strassman
D) Einstein
E) Fermi
PREGUNTA 14 :
En el experimento de Rutherford la placa que utiliza es de:
A) cobre
B) oro
C) platino
D) plata
E) cromo
PREGUNTA 15 :
Descubrió el núcleo atómico:
A) Thomson
B) Dalton
C) De Broglie
D) Bohr
E) Rutherford
PREGUNTA 16 :
El modelo atómico de Bohr solo es útil para el átomo de:
A) litio
B) calcio
C) potasio
D) hidrógeno
E) oxígeno
PREGUNTA 17 :
El modelo atómico que se asemeja a un sistema planetario es el de:
A) Thomson
B) Rutherford
C) Bohr
D) Dalton
E) Pierre
PREGUNTA 18 :
Curie Completar: "El británico ______ descubrió el neutrón"
A) Thomson
B)Chadwick
C) Millikan
D) Crookes
E) Roentgen
PREGUNTA 19 :
En el experimento de Rutherford la radiación utilizada fue rayos :
A) alfa
B) beta
C) gamma
D) catódicos
E) X
PREGUNTA 20 :
El núcleo del átomo posee carga:
A) positiva
B) neutra
C) negativa
D) no tiene carga
PREGUNTA 21 :
Descubrió los rayos canales:
A) Becquerel
B) Planck
C) Mendeléiev
D) Goldstein
E) Dalton
PREGUNTA 22 :
Se le conoce como "budín con pasas" al modelo de:
A) Bohr
B) Thomson
C) Rutherford
D) Dalton
E) Sommerfield
PREGUNTA 23 :
El átomo es eléctricamente neutro, es un postulado de:
A) Rutherford
B)Thomson
C) Dalton
D) Bohr
E) Einstein
PREGUNTA 24 :
Según los postulados de Bohr, cuando un electrón salta de un nivel inferior a uno superior:
A) libera energía
B) no pasa nada
C) absorbe energía
D) se desvanece
E) explota
PREGUNTA 25 :
¿Quién dijo que el átomo es una esfera indestructible e indivisible?
A) Thomson
B) Rutherford
C) Dalton
D) Bohr
E) Sommerfield
PREGUNTA 26 :
Una de las primeras personas que hablaron de la existencia del átomo fue:
A) Bohr
B) Leucipo
C) Platón
D) Rutherford
E)Chadwick
PREGUNTA 27 :
¿Quién descubrió, que el átomo contiene órbitas definidas circulares, que tienen una energía determinada?
A) Dalton
B) Bohr
C) Rutherford
D) Thomson
E) Leucipo
PREGUNTA 28 :
El nombre "cuánto de energía" se utiliza en el modelo atómico:
A) de Bohr
B) de Thomson
C) actual
D) de Dalton
E) de Chadwick
PREGUNTA 29 :
Si un electrón salta de un nivel superior a uno inferior:
A) absorbe energía
B) libera energía
C) se disuelve
D) no pasa nada
E) se agranda
PREGUNTA 30 :
El modelo atómico de Thomson fue realizado en el año:
a) 1999
b) 2001
c) 1863
d) 1898
e) 2006
SEGUNDA PRACTICA
PREGUNTA 1 :
"Los electrones son partículas negativas que se mueven alrededor del núcleo", es un postulado del modelo atómico de:
A) Bohr
B) Dalton
C) Rutherford
D) Thomson
E) Davy
PREGUNTA 2 :
¿Cuál de las siguientes afirmaciones es incorrecta?
A)Rutherford descubrió el núcleo bombardeando a una lámina de oro con rayos alfa.
B) El modelo del sistema planetario fue propuesto por Thomson.
C) Thomson fue quien descubrió el electrón en 1898.
D) El átomo macizo corresponde a Dalton.
E) Thomson proporcionó un modelo para el átomo en el cual los electrones carecen relativamente de movimiento.
PREGUNTA 3 :
El filósofo griego Leucipo y su discípulo demócrito sostenían que la materia era de naturaleza:
A) permanente
B) continua
C) infinita
D) discontinua
E) ondulatoria
PREGUNTA 4 :
El término Alquimia procede del _______ “Alkimiva” derivada a su vez del _______ que significa jugo de una planta.
A) chino - árabe
B) griego - árabe
C) latin - griego
D) árabe - griego
E) griego - latín
PREGUNTA 5 :
Señalar la relación correcta:
A) Thales de Mileto : Fuego
B) Anaxímenes : Agua
C) Empédocles : Agua
D) Heráclito : Tierra
E) Aristóteles : Humedad
PREGUNTA 6 :
Fueron precursores de los químicos modernos:
A) iatroquímicas
B) latroquímicos
C) alquimista
D) flogistas
PREGUNTA 7 :
De acuerdo a la concepción filosófica el aire era _______ y _______ .
A) caliente – seco
B) caliente – húmeda
C) fría – húmeda
D) fría – seca
E) caliente – fría
PREGUNTA 8 :
Para _______ el mundo material estaba formada por 4 elementos y por dos fuerzas cósmicas que son el _______ y el _______ .
A) Paracelso – átomo – aire
B) Empédocles – amor – aire
C) Heráclito – amor –odio
D) Demócrito – amor – odio
PREGUNTA 9 :
Considerado como el Aristóteles de la Edad Media:
A) Geber
B) Paracelso
C) San Alberto Magno
D) Bacon
E) Santo Tomás de Aquino
PREGUNTA 10 :
No planteó Dalton:
I)Los átomos son indivisibles e indestructibles
II)Los átomos de un mismo elemento tienen propiedades diferentes.
III) Toda reacción química es un reordenamiento de átomos.
A) sólo I
B) sólo II
C) sólo III
D) I, II
E) I, II, III
PREGUNTA 11 :
La existencia de partículas subatómicas fundamentales como el protón, _______ y _______ , invalidó en la actualidad uno de los postulados de Dalton.
A) megatrón – electrón
B) neutrón – electrón
C)neutrón – positrón
D) positrón – electrón
E)neutrón – mesón
PREGUNTA 12 :
Los Alquimistas buscaban la piedra filosofal que convertiría los metales en _______ y el elixir de la vida que era un brebaje que eliminaría las _______ y aseguraría la _______ .
A) aluminio – bondades – paz
B) cobre – contradicciones – perseverancia
C) oro – enfermedades – inmortalidad
D) cobalto – contradicciones – inmortalidad
E) mercurio – maldades – inmortalidad
PREGUNTA 13 :
Indicar la afirmación incorrecta según la filosofía griega:
I) La teoría atómica atomística fué planteada por Aristóteles.
II) La materia tiene un límite de división llamado átomo, fue planteado por Demócrito.
III) Defensores del átomo fueron Aristóteles y Thales.
A) sólo I
B) sólo II
C) sólo III
D) I, II
E) I, III
PREGUNTA 14 :
Uno de los postulados de Dalton, dice: “Los átomos de un mismo _______ son iguales en peso y difieren de los _______ de otros elementos.
A)compuesto – compuestos
B)elemento – átomos
C)grupo – átomos
D)compuesto – átomos
E) elemento – elementos
PREGUNTA 15 :
Para Dalton, la materia estaba formada por partículas _______ , llamadas _______ .
A) indivisibles – quarks
B) indivisibles – átomos
C) indestructibles – quarks
D) infinitos – electrón
E) invisible – electrón
PREGUNTA 16 :
A las radiaciones electromagnéticas se les denomina también:
A) Energía polar
B) Energía cinética
C) Energía cabrica
D) Energía radiante
E) Energía
PREGUNTA 17 :
La luz visible es un tipo de:
A) Energía
B) Radiación cósmica
C) Radiación
D) Radiación electromagnética
E) Materia
PREGUNTA 18 :
Las ondas electromagnéticas transportan energía pero no transportan:
A) Sombra
B) Materia
C) Energía
D) Medios
E) Sentimientos
PREGUNTA 19 :
Es un ejemplo de ondas hertzianas:
A) Rayos gamma
B) Radiación visible
C) Rayos X
D) Microondas
E) Rayos cósmicos
PREGUNTA 20 :
Creador de la Física Moderna o Física Cuántica.
A) Maxwell
B) Clausius
C) Rutherford
D) Dalton
E) M. Planck
PREGUNTA 21 :
El principio de incertidumbre que nos indica que la posición y la velocidad del electrón no se pueden calcular simultáneamente fue propuesto por:
A) M. Planck
B) E. Schrodinger
C) N. Bohr
D) W. Heisemberg
E) L. Meitner
PREGUNTA 22 :
Las ondas son _______ que afectan a un medio determinado.
A) objetos
B) espacios
C) entes
D) perturbaciones
E) líquidos
PREGUNTA 23 :
Las ondas que no necesitan de un medio para propagarse se denominan:
A) Mecánicas
B) Térmicas
C) Eléctricas
D) Electromagnéticas
E) Eólicas
PREGUNTA 24 :
En una onda electromagnética los campos que interactúan forman:
a) 30º
b) 60º
c) 45º
d) 37º
e) 90º
PREGUNTA 25 :
El valor de la velocidad de la luz en el vacío es:
A) 400 000 km/s
B) 400 000 m/s
C) 30000 km/s
D) 40 000 km/s
E) 300 000 km/s
PREGUNTA 26 :
Las partículas grandes como las pelotas de tenis siguen las reglas de la “mecánica clásica”, mientras que las partículas pequeñas como las partículas subatómicas obedecen a una clase diferente de mecánica llamada:
A) Microscópica
B) Macróscopica
C) Cuántica
D) Rústica
E) Racional
PREGUNTA 27 :
El autor del trabajo por el cual se supo que los electrones en los átomos se pueden tratar más como ondas que como pequeñas partículas fue:
A) Planck
B) Bohr
C) Louis De Broglie
D) Rutherford
E)Thomson
PREGUNTA 28 :
El principio que nos dice que no podemos conocer en forma simultánea la velocidad y la posición de una partícula subatómica fue propuesto por:
A) Max Planck
B) Lise Meitner
C) Bohr
D) Heisemberg
E) Sommerfeld
PREGUNTA 29 :
Las ondas de radio en la región AM tienen frecuencias en el rango 550 kHz. A 1600 kHz. Calcular la longitud de onda que corresponde a una onda de radio de una frecuencia de 1,255 MHz.
A) 1
B) 2
C) 3
D) 4
E) 5