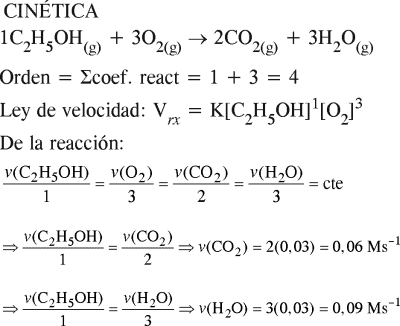CINÉTICA QUÍMICA EJERCICIOS RESUELTOS PDF
PROBLEMA 1 :
Indique verdadero (V) o falso (F) respecto a la cinética química :
I) Al inicio , la velocidad de los reactantes es mayor.
II) Son factores que afectan a la velocidad de reacción: temperatura, concentración , catalizador .
III) La oxidación del azufre pulverizado corresponde a una reacción rápida .
A) VVF
B) FFV
C) VVV
D) FFV
E) FFF
RESOLUCIÓN :
I) VERDADERO
La velocidad al inicio es máxima, puesto que se tiene la mayor concentración.
«Ley Acción de masas»
II) VERDADERO
Factores que afectan la velocidad.
* Concentración
* Temperatura
* Tamaño de las partículas
* Catalizador
III) VERDADERO
El menor tamaño de partículas del S (azufre) aumenta la velocidad de reacción.
Rpta. : "C"
PROBLEMA 2 :
La reacción:
C2H5OH(g)+3O2(g)→2CO2(g)+3H2O(g)
transcurre a una temperatura de 120ºC, en una sola etapa, es de cinética simple o elemental. Determine el orden de la velocidad de la reacción. En cierto instante, la velocidad de desaparición del etanol C2H5OH(g) fue de 0,03 Ms–1, para ese instante calcule la velocidad instantánea de aparición del CO2(g) y del H2O(g).
A) 4 0,09 Ms–1 0,06 Ms–1
B) 3 0,09 Ms–1 0,06 Ms–1
C) 4 0,06 Ms–1 0,09 Ms–1
D) 3 0,06 Ms–1 0,09 Ms–1
E) 2 0,03 Ms–1 0,06 Ms–1
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 3 :
Señale el enunciado falso relacionado con la velocidad de una reacción química :
A) Cambia con el incremento de la temperatura.
B) Depende de la naturaleza de los reactantes.
C) Varía con el empleo de catalizadores.
D) Es menor al inicio de la reacción.
E) Depende de la concentración de los reactantes.
RESOLUCIÓN :
Las reacciones siempre necesitan un cierto intervalo de tiempo para verificarse ; este tiempo varía ampliamente ; unas reacciones se realizan en una fracción de segundo , otras duran horas, días, incluso años .
En la velocidad de reacción influyen varios factores: Naturaleza de los reactivos , temperatura , concentración de los reactivo , catalizadores .
Al inicio los reactantes tienen mayor concentración y a medida que transcurre el tiempo de reacción va disminuyendo su concentración . Algo análogo sucede con la velocidad de reacción . De acuerdo a la ley de acción de las masas : la velocidad es directamente proporcional a la concentración.
Rpta. : "D"
PROBLEMA 4 :
La cinética química estudia la velocidad de las reacciones químicas. Hay dos grandes teorías que intentan explicar la cinética de las reacciones químicas: la teoría de las colisiones, basada en colisiones entre reactantes y la teoría del estado de transición centrada en la formación de una especie intermedia de corta duración denominada complejo activado. Con respecto a la cinética química, seleccione cuáles de las siguientes proposiciones son correctas.
I) La velocidad de desaparición de los reactante(s) está en función del cambio de su concentración por unidad de tiempo.
II) Según la teoría de colisiones todos los choques entre las sustancias reactantes generan los productos de la reacción.
III) El complejo activado presenta mayor energía con respecto a la de los reactantes y con respecto a la de los productos.
A) solo I
B) solo II
C) solo III
D) II y III
E) I y III
RESOLUCIÓN :
l. CORRECTO
La velocidad se calcula a través de la variación de concentración, ya sea de reactantes o productos por unidad de tiempo.
II. INCORRECTO
No todos los choques intermoleculares producen una reacción química; para que esta ocurra las colisiones deben ser eficaces, es decir, las colisiones deben tener orientación apropiada y alcanzar la energía de activación.
III. CORRECTO
El complejo activado también se le denomina estado de transición de mayor energía en todo el proceso químico y que generalmente se descompone para formar los productos. El complejo activado tiene mayor energía con respecto a la de los reactantes y con respecto a la de los productos.
Rpta. : "E"
PROBLEMA 5 :
La descomposición
ocurre mediante una reacción sencilla a 325ºC. ¿Cuál será la concentración final, en mol/L, del N2O5 a los 200 segundos, luego de haber iniciado la reacción con una concentración inicial del N2O5(g) de 6,50×10–4 mol/L y cuando el valor de k es 5×10–4 s–1?
A) 6,50×10–5
B) 2,50×10–7
C) 6,25×10–4
D) 3,45×10–4
E) 5,85×10–4
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 6 :
Indique verdadero (V) o falso (F) respecto a la cinética química :
I) Una reacción endotérmica tiene una energía de activación negativa .
II) Un catalizador aumenta el rendimiento de una reacción en equilibrio , porque aumenta la velocidad de la reacción a favor de los productos .
III) Una reacción reversible indica que la velocidad de la reacción directa es igual a la velocidad de la reacción inversa
IV) La velocidad de una reacción se define como la disminución de la concentración de un reactante y el aumento de la concentración de un producto , ambos respecto al tiempo .
V) A mayor energía de activación mayor velocidad de reacción .
A) VFVVV
B) VVFVV
C) VFFVV
D) FFFFF
E) FFFVF
RESOLUCIÓN :
I) FALSA
La energía de activación es la mínima energía que los reactantes absorben para transformarse en productos . Entonces la energía es positiva .
II) FALSA
Un catalizador no altera el estado de equilibrio por lo que la concentración de los reactivos y productos no varía . Entonces la eficiencia de la reacción no varía .
III) FALSA
Una reacción reversible no necesariamente está en equilibrio . En el equilibrio, la velocidad directa e inversa son iguales.
IV) VERDADERA
La velocidad de una reacción se define como el cambio de concentración de los reactivos o productos en un cierto intervalo de tiempo. Para los reactantes , la concentración disminuye, mientras que para los productos , la concentración aumenta .
V) FALSA
Las reacciones con mayor energía de activación ocurren con menor velocidad , es decir , son lentas .
Rpta. : "E"
PROBLEMA 7 :
La naturaleza de los reactivos, la superficie de contacto, la concentración de los reactantes, la presencia de catalizadores, son factores que influyen en la velocidad de reacción química. Respecto a ello, indique cuales de las siguientes proposiciones son correctas.
I) Una pieza de metal reacciona más rápido con HCℓ 0,03 M que con HCℓ 0,1 M.
II) Un trozo de madera arde más rápido al convertirlo en aserrín.
III) Un catalizador acelera la velocidad de una reacción por que disminuye la energía de activación.
A) solo I
B) solo II
C) solo III
D) II y III
E) I, II y III
RESOLUCIÓN :
l. INCORRECTA
El HCℓ 0,03 M contiene menos moléculas que interactúa con la pieza del metal, por lo que su velocidad de reacción será lenta en comparación al ácido de mayor concentración.
II. CORRECTA
Cuando el trozo de madera se divide, aumenta su superficie de contacto, por lo que habrá mas lugares donde pueda arder; razón por la cual aumenta su velocidad de reacción.
III. CORRECTA
Un catalizador disminuye la energía de activación, que es la energía necesaria para que inicie una reacción, por lo que hará que la reacción se efectúe más rápido.
Rpta. : "D"
PROBLEMA 8 :
Indique verdadero (V) o falso (F) respecto a la cinética química :
I) Respecto a la velocidad de reacción. La constante cinética de reacción para un sistema en fase gaseosa puede ser modificada por una variación de la presión , manteniendo la temperatura constante.
II) Respecto a la velocidad de reacción , cuando los gramos de un reactante sólido tienen el diámetro más pequeño su velocidad de reacción aumenta , pues su área superficial total de reactante es mayor.
III) Respecto a la velocidad de reacción , en algunas reacciones catalíticas, la masa del catalizador disminuye al culminar la reacción.
IV) Cuando se perturba un sistema en equilibrio, tiene lugar una reacción; luego de cual se establece un nuevo equilibrio
A) VFVV
B) VVFV
C) VFFV
D) FVFV
E) FFVV
Rpta. : "D"
PROBLEMA 9 :
Indique verdadero (V) o falso (F) según corresponda:
I) A mayor concentración , mayor velocidad de reacción.
II) La velocidad de reacción aumenta cuando hay mayor grado de división de las partículas de los reactantes.
III) Los catalizadores no afectan a las velocidades de reacción .
A) VVV
B) VVF
C) FFV
D) FVF
E) FFF
Rpta. : "B"
PROBLEMA 10 :
El trióxido de azufre (SO3) es una sustancia intermediaria en la formación de la lluvia ácida. Su formación en la atmósfera puede generarse por la reacción del dióxido de azufre (SO2) con el oxígeno (O2) del aire, representado por la siguiente ecuación:
SO2(g) + O2(g) ⟶ SO3(g)
Si en la reacción, el oxígeno desaparece a una velocidad de 3,0 M/min, calcule la velocidad de formación del SO3(g) en M/s.
A) 3,5×10–2
B) 5,0×10–2
C) 8,0×10–2
D) 1,0×10–2
E) 2,5×10–2
Rpta. : "B"
PROBLEMA 11 :
En el siglo XIX, el químico Bernard Courtois se percató de la presencia de un gas violeta cuando se encontraba estudiando algas pardas; años más tarde se descubrió que dicho gas era un nuevo elemento al que denominaron yodo, del griego iodes, que significa violeta. Una de las maneras de producir dicho gas se puede representar bajo el siguiente mecanismo de reacción:
H2(g) + ICℓ(g) → HI(g) + HCℓ(g) … (etapa lenta)
HI(g) + ICℓ(g) → I2(g)+ HCℓ(g) … (etapa rápida)
Con respecto al mecanismo de reacción presentado, seleccione el valor de verdad (V o F) de las siguientes proposiciones:
I) La ecuación global es:
H2(g) + 2ICℓ(g) → I2(g)+ 2HCℓ(g)
II) El HI es una especie intermediaria.
III) La ley de la velocidad de reacción es: Vr×n = k [H2] [ICℓ]
A) FVF
B) VVV
C) FFV
D) VFF
E) VVF
Rpta. : "B"
PRACTICA DE CLASE
PREGUNTA 1 :
En general la velocidad de una reacción química :
I) Aumenta cuando se aumenta la temperatura.
II) Aumenta cuando se aumenta la concentración de las sustancias reaccionantes.
III) Aumenta si la reacción se realiza en presencia de un inhibidor.
A) Solo I
B) Solo II
C) Solo III
D) Solo I y II
E) Todos
PREGUNTA 2 :
¿Qué factor no determina la velocidad de reacción?
A) Catalizador
B) Temperatura
C) Grado de división
D) Densidad
E) Naturaleza de los reactantes
PREGUNTA 3 :
Indicar V o F sobre la cinética de una reacción :
I) La velocidad de una reacción se incrementa al disminuir la energía de activación por medio de un catalizador.
II) La velocidad de formación de los productos al inicio es máxima.
III) La velocidad de reacción se altera con la temperatura.
A) VFV
B) VVF
C) VFF
D) FFF
E) FFV
PREGUNTA 4 :
¿Cómo influye la superficie de contacto de un sólido de una reacción?
A) No influye
B) A mayor superficie menor velocidad
C) A menor superficie menor velocidad
D) Si la superficie es rugosa no hay reacción
E) No hay variación regular
PREGUNTA 5 :
¿Qué factor influye en la velocidad de una reacción?
A) Punto de ebullición
B) Número de Avogadro
C) Temperatura
D) Densidad
E) Hay dos respuestas
PREGUNTA 6 :
Respecto a la cinética química, marque la proposición incorrecta:
A) Los catalizadores no se consumen durante la reacción.
B) El color, la densidad y la viscosidad no son factores que modifican la velocidad.
C) Según la ley de acción de masas, la velocidad de una reacción es proporcional a la concentración de los productos.
D) Al aumentar la temperatura, aumenta el número de colisiones eficaces entre los reactivos.
E) La gasolina vaporizada se consume con mayor rapidez que la gasolina líquida.
PREGUNTA 7 :
La velocidad de la reacción química aumenta cuando:
A) Disminuye la temperatura.
B) Disminuye la concentración
C) Se deja agitar
D) Aumenta la temperatura
E) Se enfría
PREGUNTA 8 :
Señale los factores que afectan el aumento de la velocidad de las reacciones químicas:
A) temperatura, viscosidad, densidad
B) presión, volumen, catalizador
C) temperatura, densidad, concentración
D) temperatura, densidad, concentración
E) concentración, temperatura, catalizador
PREGUNTA 9 :
Señale el enunciado incorrecto respecto con la velocidad de una reacción:
A) Cambia con el incremento de la temperatura
B) Depende de la naturaleza de los reactantes
C) Varía con el empleo de catalizadores
D) Es menor al inicio de la reacción
E) Depende de la concentración de los reactantes
PREGUNTA 10 :
¿Qué factor influye en la velocidad de reacción química?
A) Densidad
B) Punto de equilibrio
C) Número de Avogadro
D) Temperatura
E) Número de átomos
PREGUNTA 11 :
¿Qué factor no afecta la velocidad de reacción?
A)Temperatura
B) Catalizador
C) Concentración
D) Color
E) Tamaño de partícula