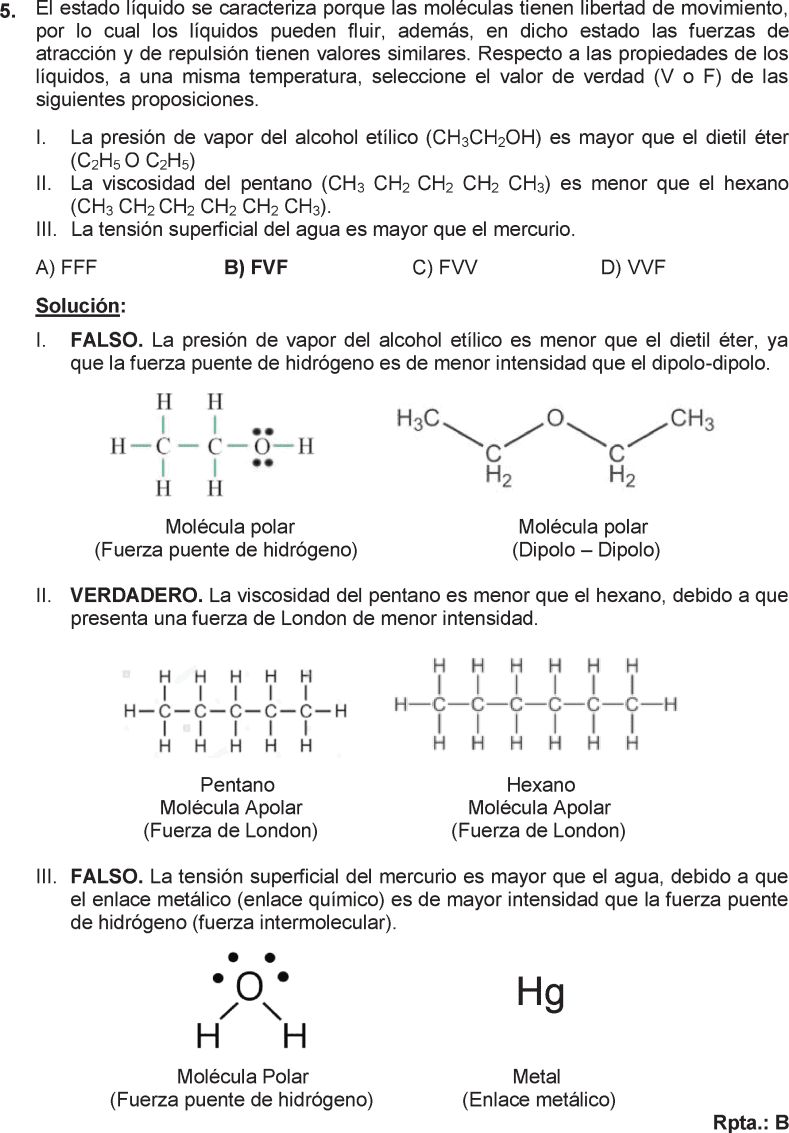
ESTADO GASEOSO EJERCICIOS RESUELTOS PDF
PROBLEMA 1 :
Respecto al estado gaseoso , indique la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F):
I) El estado gaseoso se presenta cuando la fuerza de repulsión supera a la fuerza de atracción .
II) Presión , temperatura y masa son los parámetros fundamentales que caracterizan a los gases .
III) Vapor es la sustancia que se comporta como gas luego de haber ganado suficiente energía .
IV) En un cambio de estado físico se requiere siempre la absorción de cierta cantidad de energía .
A) FVVV
B) VFVV
C) FFFV
D) VVVV
E) VFVF
RESOLUCIÓN :
I) VERDADERO
En los gases predominan las fuerzas de repulsión sobre la atracción molecular
II) FALSO
El comportamiento de los gases se describe con los parámetros:
presión (P), volumen (V) y temperatura (T): variables de estado.
II) VERDADERO
El vapor es una sustancia que cambiado a este estado debido al calentamiento (no es gas).
IV) FALSO
Para llevar a cabo un cambio de estado es necesario modificar la energía , pero no siempre por absorción
Rpta. : "E"
PROBLEMA 2 :
Si 10L de gas oxígeno se encuentran a la temperatura de 20°C y 2 atm de presión, calcular el volumen que ocuparía el oxígeno a condiciones normales.
A) 1,86 L
B) 186 L
C) 0,93 L
D) 9,30 L
E) 18,60 L
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 3 :
Por gases ideales se entiende los gases que :
A) Reaccionan mejor con otras sustancias.
B) Se encuentran en el espacio interestelar.
C) Se encuentran en los pozos de petróleo.
D) Se licuan fácilmente por acción de la presión.
E) Cumplen exactamente las leyes químicas sobre el estado gaseoso.
RESOLUCIÓN :
Un gas es toda sustancia que verifica las propiedades del estado gaseoso , como el predominio de las fuerzas intermoleculares de repulsión sobre las de atracción. Un gas ideal verifica las leyes del estado gaseoso y está definido por los postulados de la teoría cinética de los gases .
Rpta. : "E"
PROBLEMA 4 :
Una muestra de oxígeno ocupa 8,5 litros a una presión de 790torr (105kPa). Si la temperatura se mantiene constante, la presión a la cual dicha muestra ocuparía 14,3 litros en torr es
A) 455,9
B) 469,6
C) 479,6
D) 481,5
E) 489,6
RESOLUCIÓN :
Establecemos:
Estado inicial
V0= 8,5L ; P0= 790 torr
Estado final
Vf = 14,3L ; Pf =?
Aplicamos la ley de Boyle.
PfVf=P0V0
Reemplazamos.
Pf ×14,3L=790 torr×8,5 L
⇒ Pf =469,6 torr
Rpta. : "B"
PROBLEMA 5 :
Determine el volumen, en litros, de un globo que contiene inicialmente 2 L de aire, medidos a 27°C y a la presión barométrica de 1 atm; cuando es llevado a lo alto de una montaña donde la temperatura es 7°C y la presión barométrica es la mitad de la presión inicial. Calcule el volumen del globo en litros.
A) 1,01
B) 3,73
C) 5,46
D) 7,46
E) 8,73
RESOLUCIÓN :
Rpta. : "B"
PROBLEMA 6 :
La relación temperatura - volumen de un gas fue investigado por:
A) Boyle
B) Avogadro
C) Pascal
D) Torricelli
E) Charles
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 7 :
Con respecto al estado gaseoso , indique la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F):
I) Generalmente , si se aumenta la presión de un gas a temperatura constante este pasa al estado líquido y eventualmente al sólido .
II) Los gases solo se difunden a través de un medio gaseoso .
III) La difución es el proceso de mezclado de un gas con otro medio generalmente gaseoso
IV) La efusión es un proceso por el cual un gas, bajo presión, se escapa de un recipiente a través de una abertura muy pequeña .
A) FVVV
B) VFVV
C) FFFV
D) VVVV
E) VFVF
RESOLUCIÓN :
I) VERDADERO
La licuación de un gas (cambio a líquido) ocurre por incremento de la presión a temperatura constante y variable (enfriamiento).
II) FALSO
Dada la elevada energía cinética de los gases (moléculas) estos pueden difundirse en cualquier medio (sólido, líquido o gaseoso).
III) VERDADERO
La difusión de los gases genera la formación de mezcla, estas son homogéneas.
IV) VERDADERO
Los gases están confinados en recipientes cerrados , pero si estas presentan aberturas en gas tiende a escapar por efusión .
Rpta. : "B"
PROBLEMA 8 :
Se tiene un pistón vertical, que encierra aire, cerrado en su parte superior por una tapa cuando se encuentra a una altura de 12 cm. Calcula el desplazamiento de la tapa si la presión disminuye en 20% manteniendo constante su temperatura.
a) Baja 4 cm
b) Sube 4 cm
c) Sube 3 cm
d) Baja 2 cm
e) Baja 3 cm
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 9 :
Respecto a los gases ideales señale la proposición incorrecta.
A) Sus partículas se consideran masa puntuales.
B) Se considera que las moléculas de un gas ideal, experimental choques elásticos .
C) Ocupa totalmente el recipiente que los contiene.
D) Se considera que las interacciones entre sus partículas son despreciables .
E) El oxígeno molecular a 180atm y 500K se comporta como gas ideal .
RESOLUCIÓN :
A) VERDADERO
Las moléculas del gas ideal poseen un volumen despreciable (nulo) por lo que se consideran masas puntuales.
B)VERDADERO
En los choques moleculares la energía cinética neta permanece constante , por lo que estos choques se consideran elásticos .
C) VERDADERO
Por su alta energía cinética ocupa todo el espacio disponible a su alcance.
D) VERDADERO
No existen fuerzas de interacción de ningún tipo entre sus moléculas
E) FALSO
Los gases reales como el oxígeno (O2) se comportan como ideales a baja presión (P =180 atm es muy alto) y altas temperaturas.
Rpta. : "E"
PROBLEMA 10 :
Halle el volumen que ocupa 132g de CO2 medidos a 8°C bajo cero y 795 torr de presión. Exprese el resultado en libros.
Datos: PV=nRT ; R=62,4 mm.HG.L.mol–1k–1
A) 70,1
B) 68,3
C) 60,2
D) 64,2
E) 62,4
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 11 :
Respecto al estado gaseoso , indique la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F):
I) La ley combinada de los gases se cumple para una masa definida de gas .
II) La ecuación del estado de los gases cumple también para líquidos .
III) Los gases ideales tienen masa nula y volumen puntual .
IV) Según Boyle, para una masa u gas a temperatura constante, si aumenta la presión el volumen también aumenta
A) FVVV
B) VFVV
C) FFFV
D) VVVV
E) VFFF
RESOLUCIÓN :
I) VERDADERO
La ley general de los gases ideales relaciona las variables de estado (P, V, y T) es un proceso isomásico (m = CTE).
II) FALSO
La ecuación de estado (PV=nRT) define el comportamiento de los gases ideales (no de los líquidos).
III) FALSO
De acuerdo a la teoría cinética molecular (TCM) las molécula del gas ideal son puntos (volumen cero) de masa característica
IV) FALSO
La ley de Boyle, establece que a temperatura constante la presión y el volumen varían de forma inversa .
Rpta. : "E"
PROBLEMA 12 :
La atmósfera de Marte está formada principalmente por dióxido de carbono (CO2). Si una muestra de 17,6g de este gas es atrapado por el Mars Exploration Rover en un recipiente de 8,2 L a 7°C, determine la presión en atm que ejerce dicho gas en el recipiente.
Datos: R= 0,082 atm L mol–1K–1
Masas atómicas: H=1; C=12
A) 13,56
B) 49,28
C) 1,23
D) 2,24
E) 1,12
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 13 :
Respecto a las consideraciones de un gas ideal señale verdadero (V) o falso (F) :
I) Las colisiones son elásticas entre las moléculas gaseosas .
II) Despreciable el volumen propio de las moléculas gaseosas .
III) Las masas gaseosas son despreciables .
A) FVF
B) FFV
C) FFF
D) VVF
E) FVF
RESOLUCIÓN :
I) VERDADERO
Los choques moleculares son elásticos , por lo que la energía cinética promedio se conserva
II) VERDADERO
Sus moléculas se consideran puntuales, su volumen es nulo.
III) FALSO
Solo el volumen molecular se desprecia , no la masa
Rpta. : "D"
PROBLEMA 14 :
Un recipiente rígido contiene 1000 litros de gas metano (CH4) a 0°C y una atmósfera. Si se libera el gas hasta que su presión disminuye a la mitad de su valor inicial, manteniendo la misma temperatura, ¿cuántos gramos de metano quedarán en el balón?
R=0,082 atm· L/mol K Masas atómicas: H=1, C=12
A) 22,3
B) 44,6
C) 357,2
D) 714,5
E) 1429,4
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 15 :
Señale lo que no corresponde a un gas ideal.
A) Los gases reales se considera comportamiento ideal a altas temperaturas y altas presiones .
B) En los gases ideales se considera que las fuerzas intermoleculares son nulas .
C) Las moléculas de un gas ideal son de masa puntual .
D) Los choques entre las moléculas de un gas ideal se consideran elásticos .
E) Se considera su masa molecular concentrada en un volumen nulo .
RESOLUCIÓN :
A) FALSO
El comportamiento ideal de los gases reales se logra a bajas presiones y altas temperaturas.
B) VERDADERO
A nivel de sus moléculas no existen fuerzas de interacción de ningún tipo.
C) VERDADERO
Sus moléculas se consideran «masas puntuales» ya que su volumen es nulo (puntos de masa característica).
D) VERDADERO
Los choques moleculares son elásticos, no existe perdida de energía.
E) VERDADERO
La masa de la molécula (masa molecular) se concentra es un punto (V=0).
Rpta. : "A"
PREGUNTA 16 :
Una mezcla gaseosa tiene la siguiente composición volumétrica: 20% H2, 40% O2 y 40% He. Halle la presión parcial de H₂ en atmósferas si la presión parcial del oxígeno es 2 atm.
A) 1
B) 2
C) 3
D) 4
E) 5
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 18 :
En un recipiente hermético de volumen V a 50ºC tenemos confinados 50 moles de O2(g), 100 moles de N2(g) y 10 moles de Ne(g). ¿Cuál de los 3 gases ejerce mayor presión en el recipiente y de producirse un pequeño orificio en este, cuál escaparía a mayor velocidad?
Datos:
O: 16 uma
N: 14 uma
Ne: 20 uma
A) O2(g) y N2(g)
B) Ne(g) y Ne(g)
C) O2(g) y Ne(g)
D) N2(g) y N2(g)
E) N2(g) y Ne(g)
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 19 :
La alternativa incorrecta, respecto a los gases, será:
A) Al no estar confinado (encerrado) tiende a la dispersión molecular .
B) La compresibilidad es una propiedad relacionada con la expansión molecular .
C) La difusión molecular favorece la expansión del gas .
D) La oposición del gas a la reducción del volumen está relacionado con la compresibilidad .
E) Para un gas ideal, a temperatura y volumen constante, la presión depende directamente del número de mol/g.
RESOLUCIÓN :
A) Correcto
Si un gas no está confinado, o encerrado en un recipiente, entonces se expandirá o dispersará en la atmósfera.
B) Incorrecto
La compresibilidad consiste en reducir la distancia intermolecular y darle al gas un menor volumen, por efecto de una presión externa
C) Correcto
Cuando un gas se expande ocupa mayor volumen y , para ello , debe dispersarse a través de un medio (difusión) .
D) Correcto
En la comprensión de un gas , el volumen disminuye , sin embargo, las moléculas se oponen a la disminución del volumen ejerciendo mayor presión .
E) Correcto
De la Ecuación Universal de los Gases
PV=nRT, además P=Cte y V=Cte
Rpta. : "b"
PROBLEMA 20 :
En un laboratorio de la UNI, se aisló y purificó una sustancia gaseosa. Mediante el experimento se encuentra que 70 g de esta sustancia ocupan 56L a 760 mmHg y 273K. Determine la fórmula molecular de dicha sustancia si su fórmula mínima es CH₂.
Datos: R =62,4 mmHg L mol–1 K–1; masas atómicas: H=1; C=12
A) C4H8
B) C2H4
C) CH2
D) C3H6
E) C5H10
RESOLUCIÓN :
Rpta. : "B"
PRIMERA PRACTICA
PREGUNTA 1 :
El instrumento para medir la presión del aire se denomina
a) Manómetro
b) Barómetro
c) Picómetro
d) Probeta
e) Bureta
PREGUNTA 2 :
El enunciado:
“A igual temperatura, la presión de un gas varía en forma inversa a la variación del volumen”
Ley que corresponde a:
a) Charles
b) Gau Lussac
c) Dalton
d) Boyle
e) Newton
PREGUNTA 3 :
Se relaciona correctamente
I) Isotérmico : Gay Lussac
II) Isobárico : Charles
III) Isocoro : Boyle – Mariotte
a) I y II
b) II y III
c) I y III
d) Sólo II
e) Sólo III
PREGUNTA 4 :
Si un manómetro registra un valor de 60,5mmHg al nivel del mar.
¿Cuál es la presión absoluta?
a) 760,5 Torr
b) 760 Torr
c) 820,5 Torr
d) 1 Torr
e) 2 Torr
PREGUNTA 5 :
Convierte 62,4°C a Kelvin
a) 330,2
b) 335,4
c) 320,5
d) 601,7
e) 421,7
PREGUNTA 6 :
A la presión del aire se llama ......
a) Presión absoluta
b) Presión manométrica
c) Presión de vacío.
d) Presión atmosférica
e) Presión hidrostática
PREGUNTA 7 :
¿Cuántas moles contiene 336L de gas a condiciones normales?
A) 10
B) 12
C) 15
D) 7,5
E) 3,0
PREGUNTA 8 :
¿Qué volumen ocupa 132g de gas propano C3H8 a condiciones normales?
A) 11,2 L
B) 33,6 L
C) 22,4 L
D) 67,2 L
E) 100 L
PREGUNTA 9 :
En un proceso isotérmico al aumentar la presión en 25% ¿Qué sucede con el volumen?
a) Disminuye 80%
b) Aumenta 80%
c) Disminuye 20%
d) Aumenta 20%
e) Nada
PREGUNTA 10 :
Un gas ocupa 2L a 25°C y 3atm. ¿A qué temperatura se encuentra 1,5l del mismo gas a 5 atm?
A) 100°
B) 99,5°
C) 75,8°
D) 60,7°
E) 54,7°
PREGUNTA 11 :
¿Cuántos gramos de oxigeno gaseoso O2 se debe mezclar con 132g de gas propano C3H8 para que su fracción molar sea 2/5?
A) 32
B) 64
C) 48
D) 96
E) 16
PREGUNTA 12 :
En un recipiente se colocan 0,05 mol de NH3 con 0,3 mol de N2O5. Calcula la fracción molar del NH3
A) 0,86
B) 0,14
C) 0,40
D) 0,60
E) 0,75
PREGUNTA 13 :
Se mezclan 4g de Hidrógeno gaseoso: H2 con 64g de gas metano: CH4. Calcula la fracción molar del H2.
A) 1/3
B) 2/3
C) 1/5
D) 2/5
E) 3/7
PREGUNTA 14 :
Determina la densidad del monóxido de carbono CO a condiciones normales.
a) 0,75 g/L
b) 1,15 g/L
c) 1,25 g/L
d) 2,25 g/L
e) 3,75 g/L
PREGUNTA 15 :
En un cilindro de 3,6L se coloca 3,2g de gas metano CH4 con 12g de gas etano C2H6. Calcula el volumen parcial del gas metano.
A) 1,2L
B) 2,4L
C) 1,5L
D) 3,0L
E) 4,2L
PREGUNTA 16 :
En un tanque cerrado se tiene 3 mol de He con 7 mol de O2. Si la presión parcial de He es 1,8 atm. Halla la presión parcial del O2.
a) 3,5 atm
b) 4,2 atm
c) 4,5 atm
d) 4,8 atm
e) 5,1 atm
PREGUNTA 17 :
En un cilindro con una presión de 1,5 atm se tiene 2 mol de O2 con 3 mol de H2. Halla la presión parcial del O2.
A) 0,6
B) 0,7
C) 0,8
D) 1,0
E) 1,2
PREGUNTA 18 :
¿Cuántos gramos de gas hilarante N2O se debe mezclar con 8,8 g de dióxido de carbono CO2 para que sus fracciones molares sean iguales?
A) 2,2
B) 3,3
C) 4,4
D) 6,6
E) 8,8
PREGUNTA 19 :
El enunciado :
“En una mezcla gaseosa a las mismas condiciones de presión y temperatura la suma de presiones parciales es igual a la presión total” corresponde a la ley de:
a) Amagat
b) Dalton
c) Boyle
d) Charles
e) Thomson
PREGUNTA 20 :
¿Cuántos gramos de H2S se deben mezclar con 2,8g de CO para que las presiones parciales sean iguales.?
A) 1,7
B) 3,4
C) 5,1
D) 6,3
E) 9,2
PREGUNTA 21 :
¿Cuántas moles contiene un tanque de 298 ml con un gas a 22°C y 1,64 atm de presión?
A) 0,01
B) 0,02
C) 0,15
D) 0,07
E) 0,04
PREGUNTA 22 :
Halla la presión que ejerce 2,8g de monóxido de carbono en un tanque de 400ml a 20°C
a) 1,5 atm
b) 3,0 atm
c) 4,5 atm
d) 6,0 atm
e) 7,5 atm
PREGUNTA 23 :
En una mezcla gaseosa de C2H6 y C4H10 la masa molecular es 46,8.
¿Cuál es la fracción del C2H6?
A) 0,2
B) 0,3
C) 0,4
D) 0,5
E) 0,6
PREGUNTA 24 :
Se mezcla moles iguales de CO2 y O2. Halla la masa molecular de la mezcla.
a) 35g/mol
b) 36g/mol
c) 37g/mol
d) 38g/mol
e) 40g/mol
PREGUNTA 25 :
Una mezcla gaseosa posee la siguiente composición volumétrica:
CH4 : 25%
C2H6 : 75%
Halla la masa molecular de la mezcla gaseosa
a) 20,4 g/mol
b) 22,4 g/mol
c) 24,5 g/mol
d) 26,5 g/mol
e) 28,2 g/mol
PREGUNTA 26 :
La suma de fracciones molares de los componentes de una mezcla es...
a) igual a 1
b) menos de 1
c) más de 1
d) 2,5
e) 1,4
PREGUNTA 27 :
Si la composición volumétrica de una mezcla gaseosa es:
O2 : 20%
N2 : 80%
Halla la fracción molar del O2
A) 0,3
B) 0,2
C) 0,4
D) 0,6
E) 0,8
PREGUNTA 28 :
Se relacionan correctamente:
I) Presión parcial : Dalton
II) Volumen parcial: Amagat
III) Fracción molar : Gay Lussac
a) Sólo I
b) Sólo II
c) Sólo III
d) I y II
e) I, II, III
CLAVES – RESPUESTAS :
1)B 2)D 3)D 4)C 5)B 6)D 7)C 8)D 9)C 10)B 11)B 12)B 13)A 14)C 15)A 16)B 17)A 18)E 19)B 20)B 21)B 22)D 23)C 24)D 25)D 26)A 27)B 28)D
¿QUÉ ES EL ESTADO GASEOSO ?
Es el estado de agregación molecular de la materia, donde las moléculas se encuentran en movimiento caótico debido a su alta energía cinética , sus moléculas están separadas debido a la fuerza de repulsión que prevalece sobre la fuerza de atracción.
* La forma y el volumen del sistema gaseoso depende del recipiente que lo contiene .
Estado gaseoso comprende : gas y vapor .
* Es el estado de la materia que tiene forma y volumen variable , las fuerzas de repulsión entre sus moléculas son mucho mayores que las fuerzas de cohesión .
* La palabra «GAS» fue inicialmente usada por el físico belga Van Helmont , a las sustancias que se desprendían al quemar madera .
GAS IDEAL
Microscópicamente el gas ideal es un modelo abstracto , que cumple con los postulados de la Teoría Cinética de los Gases .
El modelo más simple de un sistema de muchas partículas es el gas ideal . Por definición es un gas que consta de partículas materiales puntuales de masa finita , entre las cuales no existen fuerzas que actúan a distancia y cuando chocan , lo hacen siguiendo las leyes de colisiones de las esferas.
Los gases suficientemente enrarecidos son los que más corresponden a las propiedades del gas ideal .
Los sistemas gaseosos ideales son aquellos regidos por generalizaciones basadas en la experiencia y en la actualidad explicadas por la teoría cinético molecular .
Un gas puede considerarse ideal a altas temperaturas y bajas presiones .
TEORÍA CINÉTICA MOLECULAR DE LOS GASES IDEALES
Un gas ideal o perfecto es aquel que se comporta como tal a altas temperaturas y baja presión y cuyas características se basan en los siguientes postulados:
I) Las moléculas de los gases son puntuales y se desplazan en distintas direcciones siempre en línea recta.
II) Las colisiones moleculares contra las paredes internas del recipiente que los contiene son perfectamente elásticas.
III) Las interacciones moleculares son nulas.
IV) La energía cinética depende de la temperatura.
CONDICIONES NORMALES (C.N.)
1 atm y 273 K
1 atm = 76 cmHg = 760 mmHg = 760 Torr
273 K = 0ºC = 32ºF
VOLUMEN MOLAR a C.N.
1 mol = 22,4 L de gas ideal
ECUACIÓN UNIVERSAL DE LOS GASES IDEALES (Ecuación de estado)
Fue dada por Benito Pablo Emilio Clapeyron (1799-1864). Ingeniero de profesión, para determinar por ejemplo el volumen de cierta masa de un gas a determinada presión y temperatura.
PV=RTn
P = presión absoluta
V = volumen (en litros)
W = masa en gramos del gas
R = constante universal
T = temperatura absoluta (en kelvin)
R = 0,082 si “p” está en atm
R = 62,4 si “p” está en mmHg
ECUACIÓN GENERAL DE LOS GASES IDEALES
Fue dada por Rodolfo Julio Manuel Clausius (1822-1888) matemático y físico alemán, considerado como el fundador de la termodinámica. La ecuación también puede escribirse considerando la densidad del gas, ya que la masa se mantiene constante.
PROCESOS RESTRINGIDOS
Son cambios que experimentan los gases manteniendo constante la masa y una de las variables de estado (presión “P”, volumen “V” o temperatura “T”).
Proceso isotérmico: Ley de Boyle-Mariotte; constante “T
Proceso isobárico: Ley de Charles; constante P
Proceso isocórico: Ley de Gay Lussac; constante “V







.png)