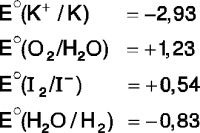ELECTROQUÍMICA EJERCICIOS RESUELTOS PDF
PROBLEMA 1 :
Señale como falso (F) o verdadero (V), según corresponda, acerca del proceso de la electrólisis
I) En un proceso espontáneo.
II) Al cátodo migran los cationes y ocurre la oxidación.
III) El ánodo es el polo negativo y ocurre la oxidación
A) VVV
B) VVF
C) VFV
D) VFF
E) FFF
RESOLUCIÓN :
I) FALSO
La electrolisis no es un proceso espontáneo porque se requiere de corriente continua para que se produzca.
II) FALSO
En el cátodo ocurre la reducción y hacia él migran cationes.
III) FALSO
El ánodo es el polo (+) y en el se produce la oxidación.
Rpta. : "E"
PROBLEMA 2 :
¿En qué caso está involucrada la electroquímica?
I) Purificación de metales.
II) La electrólisis es el proceso mediante el cual se entrega energía eléctrica a un sistema para que ocurra una reacción química no espontánea.
III) Metalización de superficies plásticas.
A) I, II y III
B) II y III
C) I y III
D) Sólo I
E) Sólo III
RESOLUCIÓN :
I) VERDADERO
Una de sus aplicaciones es la obtención de sustancias simples puras por electrólisis , como el caso de purificación del cobre a partir del cobre búster (cobre negro).
II) VERDADERO
En este dispositivo ocurre una reducción redox no espontánea (electrólisis) debido al paso de la corriente eléctrica .
III) VERDADERO
La galvanoplastia es la técnica de recubrimiento metálico por electrólisis sobre materiales, pudiendo ser:
* Cromado
* Plateado
* Dorado , etc
Rpta. : "A"
PROBLEMA 3 :
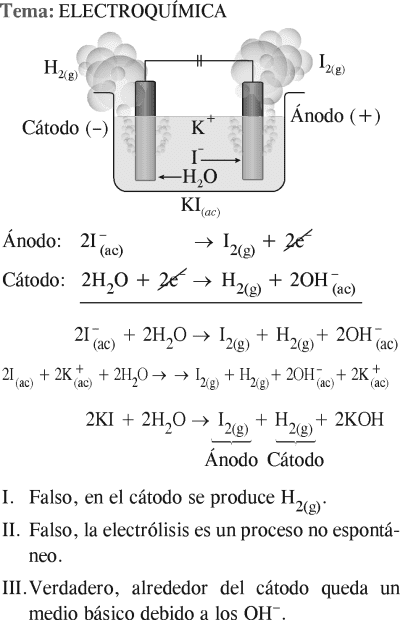
Dadas las siguientes proposiciones con respecto a la electrólisis de una solución de ioduro de potasio (KI), ¿cuáles son correctas?
I) Se produce iodo (I2) en el cátodo.
II) La reacción se lleva a cabo de manera espontánea.
III) La solución que rodea al cátodo cambia a fucsia con la adición de fenolftaleína.
Potencial estándar de reducción (V)
A) solo I
B) solo II
C) solo III
D) I y III
E) I, II y III
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 4 :
Indique verdadero (V) o falso (F) según corresponda:
I) La electrólisis es un proceso que tiene lugar al pasar la corriente eléctrica a través de un sistema formado por dos electrodos y masa fundida o disolución de un electrolito .
II) Durante la electrólisis , en el electrodo negativo, cátodo, se lleva a cabo la reducción
III) Durante la electrólisis , en el electrodo positivo, ánodo, se lleva a cabo la oxidación.
IV) Durante la electrólisis los iones positivos presentes se dirigen hacia el cátodo, y lo iones negativos se dirigen hacia el ánodo.
A) VFFV
B) FVVF
C) FVFV
D) FFFV
E) VVVV
RESOLUCIÓN :
I) VERDADERO
La electrólisis consiste en hacer pasar corriente eléctrica continua a través de un electrolito a la masa fundida de una sustancia.
II)VERDADERO
El cátodo es el electrodo negativo y en él se produce la reducción .
III) VERDADERO
En el ánodo que es el polo positivo se produce la oxidación.
IV) VERDADERO
Los iones positivos se dirigen hacia el cátodo (negativo); por esto se denominan cationes
Rpta. : "E"
RESOLUCIÓN :
Rpta. : "B"
PROBLEMA 6 :
Indique cuál de las siguientes proposiciones es incorrecta con respecto a las celdas electrolíticas :
A) Se llevan acabo reacciones redox .
B) Generan corriente eléctrica .
C) Sobre el electrodo positivo se lleva a cabo la oxidación.
D) Sobre el cátodo se realiza la reacción de reducción.
E) Los electrodos pueden ser activos y/o inertes.
RESOLUCIÓN :
Características de la electrólisis :
Es un proceso redox de descomposiciones.
Se emplea corriente eléctrica contínua.
Reacciones
Ánodo (+): oxidación
Cátodo (–): reducción
Los electrodos citados pueden ser activos o inertes.
Rpta. : "B"
PROBLEMA 7 :
Un estudiante analiza los potenciales de reducción del aluminio y hierro:
De su análisis deduce que el aluminio debería corroerse más fácilmente que el hierro y, siendo así, una lata hecha de aluminio con gaseosa debería corroerse más rápidamente. Por lo tanto, las latas de gaseosa deberían hacerse de hierro. Sin embargo, esto no ocurre así. ¿Cuál es la razón por la cual ese proceso de corrosión no se observa en las latas de aluminio?
A) Debido a la capa de óxido de aluminio (Aℓ2O3) que se forma en la superficie del metal y lo protege.
B) El potencial de oxidación del aluminio es muy bajo.
C) El aluminio es pintado con alguna capa de barniz.
D) Se forma carbonato de aluminio insoluble. Aℓ2(CO3)3, sobre el metal y lo protege.
E) El líquido de una gaseosa no es un medio corrosivo.
RESOLUCIÓN :
Rpta. : "A"
PROBLEMA 8 :
Respecto a la electrólisis señale la proposición verdadera (V) o falsa (F).
I) Las reacciones que se producen en una celda electrolítica son espontáneas .
II) Tanto en una celda galvánica como en una celda electrolítica, los electrones se desplazan desde el ánodo hacia el cátodo.
III) Los electrodos de las celdas electrolíticas suelen ser inertes.
A) VVV
B) VFV
C) VVF
D) FVV
E) FFF
RESOLUCIÓN :
I) FALSO
Los procesos electrolíticos son no espontáneos , las reacciones redox son forzadas por el paso de la electricidad.
II) VERDADERO
En los dos tipos de celda , electrolítica y galvánica la oxidación ocurre en el ánodo y la reducción en el cátodo, por lo que el flujo de electrones tiene la dirección.
III) VERDADERO
Por lo general los electrodos de una celda electrolítica son inertes (no sufren cambios).
Rpta. : "D"
PROBLEMA 9 :
La masa en gramos que se deposita al hacer pasar 0,9 Faraday por una celda electrolítica que contiene Aℓ+3 es
A) 0,9
B) 2,7
C) 8,1
D) 24,3
E) 27,0
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 10 :
Indique las proposiciones que satisface a la pregunta:
¿Por qué el ánodo de una celda electrolítica es positivo , mientras que una celda voltaica es negativo?.
I) Los términos ánodo y cátodo no se asignan basándose en las cargas sino en las semirreacciones que tienen lugar en su superficie.
II) En ambas celdas la oxidación implica ganancia de electrones.
III) En una celda galvánica la reducción ocurre en el ánodo.
A) Sólo I
B) Sólo II
C) Sólo III
D) I y II
E) II y III
RESOLUCIÓN :
¿Por qué el ánodo de una celda electrolítica es positivo y de una celda voltaica es negativo?. Esto se debe a que :
En la celda electrolítica el proceso es no espontáneo por lo que para que anión se oxiden , el ánodo debe atraerlo , debe poseer carga contraria (+).
En la celda voltaica el proceso es espontáneo , la oxidación que ocurre en el ánodo hace que este cargue (–) debido a los electrones perdidos que por el se canalizan. Pero indiferente al tipo de celda en el ánodo ocurre la oxidación y el cátodo la reducción , lo cual es la manera de reconocerlo .
Rpta. : "A"
PROBLEMA 11 :
En la galvanoplastía se emplea corriente eléctrica para depositar un metal sobre otro.
¿Cuántos segundos se necesitan para depositar 0,635 g de cobre sobre una moneda de hierro, al hacer pasar una corriente de 0,965 amperios?
Dato: masa atómica Cu: 63,5g
A) 1000
B) 200
C) 20
D) 1800
E) 2000
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 12 :
Se sabe que pequeñas cantidades de sales disueltas en el agua potable la hacen conductora de la corriente eléctrica.
En la figura se representa una celda electrolítica que contiene agua potable, por la que se hace pasar la corriente eléctrica y se produce la electrólisis del agua según la ecuación
Establezca el valor de verdad (V o F) para los siguientes enunciados:
I) En el cátodo (–) ocurre la reducción y en el ánodo (+) la oxidación.
II) Durante la electrólisis, se libera oxígeno gaseoso en el ánodo ( +).
III) En ambos electrodos se libera igual número de moles de H2(g) y O2(g)
A) VVV
B) FVF
C) FFF
D) VFV
E) VVF
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 13 :
Indicar si las siguientes proposiciones son verdaderas (V) o falsas (F) con respecto a los procesos electroquímicos .
I) Generan corriente eléctrica .
II) Producen cambios en el estado de oxidación de los reactantes .
III) Son responsables de la corrosión de estructuras metálicas.
A) VVV
B) FVV
C) VFV
D) VVF
E) FFV
RESOLUCIÓN :
I) VERDADERO
La generación de corriente eléctrica es un proceso electroquímico , que se lleva a cabo en las celdas galvánicas o voltaicas.
II) VERDADERO
Dicho proceso involucran reacciones redox espontáneas y no espontáneas , debido a la oxidación y reducción hay cambios en los estado de oxidación .
III) VERDADERO
La corrosión de los metales es un proceso electroquímico donde hay deterioro de las superficies (oxidación) por acción del aire y la humedad.
Rpta. : "A"
PROBLEMA 14 :
En una celda electrolítica se tiene inicialmente 0,5 L de una solución de sulfato cúprico (CuSO4) 0,4 M. Sobre esa solución se aplica una corriente eléctrica cuya intensidad es de 2,5 A durante 60 minutos. Considerando que el volumen de la solución se mantiene constante, calcule la molaridad (en mol/L) final de la solución.
Constante de Faraday (F) = 96 500 C/mol; masa atómica: Cu =63,5
A) 0,0
B) 0,1
C) 0,2
D) 0,3
E) 0,4
RESOLUCIÓN :
Rpta. : "D"
PROBLEMA 15 :
Dos celdas electrolíticas conteniendo soluciones de SnF2 y FeCl3, respectivamente, están conectadas en serie. Después de un cierto tiempo, en la primera celda se deposita 5 gramos de estaño. La masa, en gramos, de hierro que se deposita en el cátodo de la segunda celda, en el mismo tiempo, es:
(masas molares, g/mol; Sn = 119; Fe= 56)
A) 1,13
B) 1,27
C) 1,37
D) 1,47
E) 1,56
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 16 :
El niquelado es un proceso mediante el cual los objetos metálicos obtienen un fino acabado, además sirve de protección contra la corrosión.
Cuando un objeto es sumergido en una solución de NiCI₂, se depositan sobre este 2,95g de Ni. Determine el volumen, en L, del gas producido en el ánodo, medidos a C.N.
Datos: Masas atómicas: Cℓ=35,5; Ni=59
A) 2,24
B) 3,36
C) 0,56
D) 1,12
E) 4,48
RESOLUCIÓN :
Rpta. : "D"
PROBLEMA 17 :
Tres celdas conectadas en serie que contienen CuSO4, AgNO3, y AℓCℓ3, respectivamente, se electrolizan a las mismas condiciones. Si en la segunda celda se depositan 0,25 g de Ag, entonces los miligramos de Cu y Aℓ que se depositarán en las otras celdas, respectivamente, son:
(P.A.: Cu=63,5; Ag=108; Aℓ=27)
A) 20,6 y 70,5
B) 28,5 y 75,2
C) 51,5 y 28,3
D) 71,3 y 35,5
E) 73,5 y 20,8
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 18 :
La fuerza electromotriz de una celda galvánica es independiente de
A) naturaleza de los electrodos.
B) concentración de los cationes.
C) concentración de los aniones.
D) temperatura del sistema.
E) volumen de los electrolitos.
RESOLUCIÓN :
La diferencia de potencial que se establece entre los dos electrodos de una celda galvánica también recibe el nombre de fuerza electromotriz (fem) de la celda galvánica.
La diferencia de potencial entre los dos electrodos de una pila galvánica o voltaica, recibe el nombre de fuerza electromotriz o potencial estándar de pila, haciendo referencia a la denominación estándar, es decir, [ ]=1m y T=298 K (25°C).
La fem puede verse influenciada por factores como: naturaleza del electrodo, concentración de iones, temperatura entre otros.
Sin embargo, el volumen de los electrolitos no tiene influencia en el cálculo de la fem.
Rpta. : "E"
PROBLEMA 19 :
Dada la siguiente información de potenciales estándar de reducción, en voltios:
Indique la representación abreviada de la celda galvánica que puede construirse y que genere el mayor potencial (en voltios).
A) Ag(s) / Ag+(1 M) || Cu2+(1 M) / Cu(s)
B) Ag(s) / Ag+(1 M) || Ni2+(1 M) / Ni(s)
C) Cu(s) / Cu2+(1 M) || Ag+(1 M) / Ag(s)
D) Cu(s) / Cu2+(1 M) || Ni2+(1 M) / Ni(s)
E) Ni(s) / Ni2+(1 M) || Ag+(1 M) / Ag(s)
RESOLUCIÓN :
Rpta. : "E"
PRIMERA PRACTICA
PREGUNTA 1 :
La intensidad de corriente eléctrica se mide en :
A) Ampere
B) Metro
C) Joule
D) Gramo
E) Volt
PREGUNTA 2 :
Para que ocurra la electrólisis la corriente debe ser :
A) Alterna
B) Continua
C) Rara
D) De alto voltaje
E) FD
PREGUNTA 3 :
Se pasaron 1500 C por una solución de nitrato de aluminio
¿ Cuál es la masa de aluminio que se deposita en el cátodo ?
A) 0,12 g
B) 0,13 g
C) 0,14 g
D) 0,15 g
E) 0,16 g
PREGUNTA 4 :
¿ Qué ocurre en el ánodo ?
A) Oxidación
B) Reducción
C) Ambos
D) Ninguno
E) FD.
PREGUNTA 5 :
¿ Qué ocurre en el cátodo ?
A) Oxidación
B) Reducción
C) Ambos
D) Ninguno
E) FD.
PREGUNTA 6 :
¿ Cuántas horas se requieren para depositar 7 gramos de cinc en la electrólisis de ZnCℓ2 cuando se usan 0,7 A ?
A) 4,17
B) 6,23
C) 9,12
D) 8,25
E) 5,43
PREGUNTA 7 :
Hallar el volumen de oxígeno en litros a C.N. que se desprende al electrolizar agua por el paso de 5 F.
A) 7
B) 14
C) 28
D) 42
E) 56
PREGUNTA 8 :
¿Cuál es la intensidad de la corriente que en 96,5 segundos deposita 1,2 mg de plata ?
A) 0,011 A
B) 21,20 A
C) 0,220 A
D) 84,65 A
E) 8,80 A
PREGUNTA 9 :
Si en el cátodo de una celda electrolítica que contiene AgNO2 se han depositado 5,4g del metal durante 965 segundos ,¿qué intensidad de corriente eléctrica se utilizó?
A) 3,5 A
B) 4,5 A
C) 4 A
D) 2,5 A
E) 5 A
PREGUNTA 10 :
¿ Cuántos faraday deben pasar por una solución electrolítica para liberar 10 g de hidrógeno ?.
A) 10 F
B) 20 F
C) 30 F
D) 40 F
E) 50 F
PREGUNTA 11 :
Calcular el tiempo necesario para que pasen 40000 coulomb por un baño electrolítico que usa una corriente de 4 amperes.
A) 10 s
B) 102 s
C) 103 s
D) 104 s
E) 105 s
PREGUNTA 12 :
Determinar la intensidad de corriente que debe circular por una solución de AgNO3 durante 1 hora para obtener 108 g de plata .
A) 26,8 A
B) 13,4 A
C) 53,6 A
D) 28,5 A
E) 23,7 A
PREGUNTA 13 :
¿ Cuántos gramos de aluminio se depositan electrolíticamente a partir de una solución que contiene Aℓ(3+) en una hora por el paso de 10 ampere?
A) 2,34 g
B) 1,34 g
C) 0,16 g
D) 0,78 g
E) 3,35 g
PREGUNTA 14 :
¿Cuántos Amperios son necesarios para que al circular la corriente eléctrica a través de una solución de sulfato cúprico, se depositen 6,35g de Cu al cabo de 1930s?
A) 50,0
B) 96,5
C) 95,6
D) 0,1
E) 10,0
PREGUNTA 15 :
¿Cuántos Coulombios se requiere para producir 5,4 g de Ag por electrólisis de una solución de nitrato de plata?
A) 9650
B) 1206
C) 3217
D) 2412
E) 4825
PREGUNTA 16 :
En una celda electrolítica, durante 4 horas se depositan 48g de Mg a partir de MgCO2. Determine la carga empleada en Faraday.
A) 1
B) 2
C) 3
D) 4
E) 5
PREGUNTA 17 :
¿ Cuánto tiempo necesita una corriente de 1,985 ampere para depositar 4 g de plata ?.
m.A (Ag)=108
A) 45 s
B) 30 min
C) 5 min
D) 58 min
E) 23 min
PREGUNTA 18 :
¿Cuántos gramos de Litio se depositan en el cátodo, cuando se realiza la electrólisis del LiCℓ fundido, con una carga eléctrica de 5,0×103 Coulombios?
A) 1,8×10–1
B) 1,8×10–2
C) 3,6×10–1
D) 3,6×10–2
E) 2,7×10–1
PREGUNTA 19 :
Se hace circular corriente eléctrica a través de dos celdas electrolíticas comunicadas entre si; en una se obtiene 2g de Ag. ¿Cuántos gramos de Cu (II) se obtiene en la otra celda?
A) 2,00
B) 1,18
C) 0,59
D) 1,00
E) 0,30
PREGUNTA 20 :
¿Cuántos gramos de Cu se obtienen a partir de una solución de CuC, al pasar una corriente de 5A durante 2,5 horas?
A) 29,06
B) 28,61
C) 30,61
D) 28,91
E) 29,61
CLAVES – RESPUESTAS :
1)A 2)B 3)B 4)A 5)B 6)D 7)E 8)A 9)E 10)A 11)D 12)A 13)E 14)E 15)E 16)D 17)B 18)C 19)C 20)E
ELECTROQUÍMICA.
☛ Celdas galvánicas o pilas: conductividad.
☛ Potenciales de la celda y diagramas de celda.
☛ Potencial estándar de reducción.
☛ Electrólisis y celdas electrolíticas: reacciones rédox en los electrodos.
☛ Aspectos cuantitativos de la electrólisis.
☛ Leyes de Faraday.
¿QUÉ ES LA ELECTROQUÍMICA?
Es una parte de la química que estudia la relación entre los procesos químicos y la energía eléctrica.
ELECTRÓLISIS
Es el proceso mediante el cual se descompone una sustancia al paso de la corriente eléctrica.
Para realizar la electrólisis se dispone:
ELECTROLITO
Es aquella sustancia que se descompone en sus iones respectivos al paso de la corriente eléctrica, y generalmente son los ácidos, las bases y las sales cuando están en solución acuosa o se encuentran fundidas.
ELECTRODOS
Son materiales que nos permiten realizar el contacto de la solución con la corriente eléctrica procedente de un generador de corriente continua.
Existen dos tipos:
CÁTODO
Es el polo negativo y se encarga de atraer los iones positivos de la solución. Se produce la reducción del catión.
ÁNODO
Es el polo positivo y se encarga de atraer los iones negativos de la solución.
Se produce la Oxidación del anión
VOLTÁMETRO
O también denominado cuba electrolítica, es el recipiente que contiene al electrolito.
ELECTRÓLISIS SAL ACUOSA
ELECTRÓLISIS DEL AGUA ACIDULADA
LEYES DE FARADAY FARADAY
Es la cantidad de electricidad necesaria para depositar o liberar un equivalente gramo de una sustancia.
1 Faraday = 1F=96500 coulombs =1mol e–
PRIMERA LEY DE FARADAY
La masa que se deposita o libera en un electrodo es directamente proporcional a la cantidad de electricidad que atraviesa el electrolito ya sea fundido o en disolución.
EQUIVALENTE ELECTROQUÍMICO
Es el peso depositado o liberado en los electrodos al paso de 1 coulomb de electricidad.
SEGUNDA LEY DE FARADAY
Si dos o más celdas electrolíticas están conectadas en serie y son atravesadas por la misma cantidad de electricidad entonces las masas que se depositan o se liberan en todos los electrodos son proporcionales a los pesos equivalentes. Que es lo mismo decir se deposita o libera el mismo número de equivalentes.
APLICACIONES DE LA ELECTRÓLISIS
☛ Depósito electrolítico de metales sobre superficies que se desea proteger, tales como por ejemplo: cromado , niquelado , cobreado y plateado
Las piezas que se desea recubrir se colocan como cátodos sumergidos en disoluciones de sales como cromo, níquel, cobre o plata.
☛ La obtención de latón (aleación Cu-Zn) puede realizarse también por este método depositándose conjuntamente al electrolizar disoluciones de sales adecuadas que tengan cobre y zinc.
☛ La obtención de cloro y de NaOH se puede realizar simultáneamente por electrólisis en disoluciones de cloruro sódico.