TABLA PERIÓDICA EJERCICIOS RESUELTOS PDF
PROBLEMA 1 :
Un elemento tiene una configuración electrónica [Ne]3s1.
Identifique las alternativas correctas:
I) Es un elemento representativo.
II) Pertenece al grupo de metales alcalinotérreos.
III) Pertenece al grupo de metales alcalinos.
IV) Es un elemento de transición.
A) I y III
B) III y II
C) I y II
D) II y IV
E) I y IV
RESOLUCIÓN :
[Ne]3s1 ⇒ Z=11
I) (V) La configuración electrónica termina en 3s1 entonces pertenece al grupo A llamado:
ELEMENTOS REPRESENTATIVOS.
II) (F) Como termina en el subnivel s1 pertenece al grupo de los METALES ALCALINOS.
III) (V)
IV) (F) Los elementos de transición pertenecen al grupo B de la T.P.A.
Rpta. : "A"
PROBLEMA 2 :
En la tabla periódica de los elementos, una de las consecuencias de la configuración electrónica es el ordenamiento de los elementos en periodos y grupos.
En el arreglo vertical se manifiestan las propiedades
A) físicas de los elementos que forman el periodo.
B) nucleares de los elementos que pertenecen al grupo.
C) nucleares de los miembros que tienen orbitales similares.
D) químicas de los elementos que forman el grupo.
RESOLUCIÓN :
En la tabla periódica, los elementos están ordenados en función al número atómico (en forma creciente) y a la configuración electrónica. Los elementos químicos se encuentran en arreglos verticales (grupos) y arreglos horizontales (periodos).
PERIODO
Los elementos presentan igual nivel de valencia (último nivel), además, sus propiedades físicas y químicas son diferentes.
GRUPO
Los elementos presentan igual número de electrones de valencia (electrones del último nivel); también presentan propiedades químicas similares pero propiedades físicas diferentes.
Los elementos de un mismo grupo tienen la misma distribución electrónica externa, por lo tanto, los elementos de una misma familia o grupo presentan propiedades químicas similares, porque cuando los átomos reaccionan para formar iones o moléculas, son los electrones más externos los que participan.
En conclusión, los elementos de un mismo grupo tienen mismo número de electrones de valencia y se puede decir que presentan las mismas propiedades químicas.
a) Incorrecta
El arreglo vertical de elementos es el grupo, no el periodo.
b) Incorrecta
En el arreglo vertical (grupo) de los elementos, se manifiestan propiedades químicas similares.
c) Incorrecta
En un grupo, los elementos presentan orbitales similares en el nivel de valencia (ejemplo: IA: ...ns1), pero las propiedades químicas son similares, mas no las nucleares.
d) Correcta
En un grupo, los elementos presentan propiedades químicas similares.
Rpta. : "D"
PROBLEMA 3 :
Determina la familia al cual pertenece el elemento cuyo átomo posee como último electrón la notación cuántica probable: n, 1, 0, –1/2
a) Anfígenos
b) Halógenos
c) Carbonoideos
d) Alcalinos térreos
e) Nitrogenoideos
RESOLUCIÓN :
Rpta. : "B"
PROBLEMA 4 :
Si la configuración electrónica de un catión de número atómico trece termina en 2p6.
Es correcto afirmar que es
I) un catión +3.
II) un metal alcalinotérreo.
III) un metal de transición.
A) Solo III
B) I y II
C) Solo I
D) II y III
E) I, II y III
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 5 :
Indique el grupo y periodo de la tabla periódica, respectivamente, correspondiente a un elemento químico cuya configuración electrónica termina en
A) IA ; 4
B) IIIA ; 3
C) VA ; 4
D) VIIIB ; 3
E) IB ; 4
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 6 :
En la tabla periódica se puede observar diferentes agrupaciones de los elementos. Una de las agrupaciones corresponde a metales, no metales y metaloides y otra en familias o grupos. En los siguientes conjuntos de elementos químicos:
Señale la alternativa correcta:
A) El conjunto II tiene algunos metales cuya configuración termina en p².
B) El conjunto II tiene dos metaloides.
C) El conjunto III tiene únicamente metales alcalinos.
D) El conjunto I tiene dos metales de transición.
E) Todos los conjuntos tienen metales alcalinos.
RESOLUCIÓN :
Rpta. : "A"
PROBLEMA 7 :
Un elemento común en la corteza terrestre, tiene los siguientes números cuánticos, para su último electrón: (4 , 0 , 0 , –1/2). Calcule a qué periodo y grupo, respectivamente, pertenece el elemento.
A) 4 y 2
B) 4 y 15
C) 2 y 17
D) 2 y 4
E) 4 y 3
RESOLUCIÓN :
Rpta. : "A"
PROBLEMA 8 :
Los gases raros constituyen un grupo de elementos químicos caracterizados por tener baja reactividad a condiciones normales de presión y temperatura.
En relación con el grupo formado por los elementos 2He, 10Ne, 18Ar, 36Kr, 54Xe y 86Rn es correcto afirmar que
A) pertenecen al grupo VIIIB de la tabla periódica.
B) todos cumplen con la regla del octeto.
C) los seis elementos son diatómicos.
D) todos tienen altos valores de energía de ionización.
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 9 :
¿Cuál de las siguientes alternativas es correcta?
A) El radio aniónico siempre es menor que el radio del átomo original.
B) Todas las afinidades electrónicas son exotérmicas y llevan signo negativo.
C) La energía de ionización es la energía necesaria para arrancar un electrón de un átomo de un compuesto sólido, y convertirlo en un catión.
D) El radio catiónico siempre es menor que el radio del átomo original.
E) La electronegatividad es la energía que se debe aplicar a un átomo para atraer a un electrón hacia sí mismo.
RESOLUCIÓN :
A) Incorrecta
Radio aniónico > Radio atómico (del átomo neutro)
B) Incorrecta
En general, la afinidad electrónica es exotérmica, pero a algunos elementos como los del grupo IIA les corresponde la afinidad electrónica endotérmica.
C) Incorrecta
La energía de ionización se calcula para el átomo libre en fase gaseosa.
D) Correcta
Radio catiónico<Radio atómico (del átomo neutro)
E) Incorrecta
La electronegatividad es la fuerza relativa del núcleo para atraer electrones que participan en el enlace.
Rpta. : "D"
PROBLEMA 10 :
De los siguientes elementos:
1) Fe
2) B
3) Aℓ
4) Ge
5) Pd
Son metaloides:
A) 1, 2 y 3
B) 1, 2 y 5
C) 3, 4 y 5
D) 1 y 5
E) 2 y 4
RESOLUCIÓN :
Los elementos metaloides poseen propiedades físicas intermedias, entre los metales y no metales, especialmente la conductividad eléctrica.
Estos elementos metaloides: B, Si, Ge, As, Sb, Te, Po y At, son usados en la fabricación de circuitos electrónicos (transistores, microchips, etc.).
Rpta. : "E"
PROBLEMA 11 :
El átomo de un elemento presenta 21 electrones en orbitales con el número cuántico magnético mℓ=0.
Entonces se puede afirmar que:
1) Se ubica en el grupo IVA de la tabla periódica.
2) Es un elemento paramagnético.
3) Se ubica en el block p.
4) Presenta un orbital vacío.
5) Se ubica en el periodo más largo de la tabla periódica.
Son ciertas
A) 1 y 4
B) 1, 2 y 4
C) 1, 3 y 4
D) 1, 2, 3 y 4
E) todas
RESOLUCIÓN :
Rpta. : "D"
PROBLEMA 12 :
La tabla periódica de los elementos es una disposición de los elementos químicos ordenados por su numero atómico, por su configuración electrónica y sus propiedades químicas. Las filas de la tabla se denominan periodos y las columnas, grupos. Si se sabe que los elementos 11Na , 12Mg, 13Aℓ, 14Si, 15P, 16S, 17Cℓ se encuentran ubicados en una misma fila de la tabla periódica, en ellos se cumple que
A) el sodio es el elemento que tiene mayor radio atómico.
B) todos tienen el mismo numero de electrones de valencia.
C) el cloro es el elemento con menor afinidad electrónica.
D) el magnesio es más electronegativo que el azufre.
RESOLUCIÓN :
Rpta. : "A"
PRIMERA PRACTICA
EJERCICIO 1 :
Señala el nombre que o corresponde
A) K → Kalium
B) Na → Natrium
C) F → Flúor
D) As → Astato
E) Sn → Estaño
EJERCICIO 2 :
Señala lo correcto :
A) Werner → Tabla den forma larga
B) Moseley → Ley periódica moderna
C) Dobereiner → Tríadas
D) Newlands → Ley de las octavas
E) Lavoisietr → En periodos y grupos
EJERCICIO 3 :
Mendeliev pronostica la existencia de elementos no descubiertos por ese entonces, excepto :
A) A los gases tóxicos
B) A los elementos líquidos
C) A los gases nobles
D) A los elementos sólidos
E) A os gases nervinos
EJERCICIO 4 :
D. Mendeleiev (1834 – 1907) ordenó a los elementos en función de :
A) Sus números atómicos
B) Sus reacciones
C) Como se descubrían
D) Sus pesos atómicos
E) Su cantidad de isótopos
EJERCICIO 5 :
Señala verdadero o falso :
( ) Ley de las octavas <> grupos de 8 en 8.
( ) Los grupos contiene elementos congéneres.
( ) Los elementos de transición forman los grupos “A”.
( ) En un periodo los elementos tiene propiedades semejantes.
A) VVFF
B) FVFF
C) VFVF
D) FFFV
E) FFVF
EJERCICIO 6 :
En la siguiente triada de J.W Dobereiner (1780 – 1849) determina la alternativa correcta.
Elemento A B C
Peso atómico x y z
A) y + z = 2x
B) z = 2y + x
C) 2x + y = z
D) z = 2y - x
E) x = y – z
EJERCICIO 7 :
El primer periodo lo conforman :
A) H y He
B) H y O
C) He y Ne
D) Li y Na
E) H y LI
EJERCICIO 8 :
¿A qué periodo y grupo pertenece el 2412Mg ?
A) 3 – IA
B) 3 – IIA
C) 3 – VIIIA
D) 4 – IIB
E) 3 – IIB
EJERCICIO 9 :
Los siguientes elementos forman una triada.
7Li xNa 39K
Determina el peso atómico del sodio.
A) 46
B) 23
C) 26,5
D) 42,5
E) 16
EJERCICIO 10 :
Relaciona correctamente :
I) Wermer
II) Dobereiner
III) Moseley
a) Ley de la triadas
b) Diseño de la tabla periódica actual.
c) Ley periódica moderna
A) Ia – IIb – IIIc
B) Ia – IIc – IIIb
C) Ic – IIa – IIIb
D) Ib – IIc – IIIa
E) Ib – IIa – IIIc
EJERCICIO 11 :
¿A qué período y grupo pertenece el siguiente elementos 10847Ag ?
A) 5 – IB
B) 5 – VIIIB
C) 5 – VIIIA
D) 4 – IB
E) 4 – VIIIB
EJERCICIO 12 :
Con respecto a la Tabla periódica actual señala verdadero (V) o falso (F) según corresponda :
( ) Existen 7 periodos.
( ) Los elementos de un mismo grupo poseen propiedades químicas muy similares.
( ) El último elemento natural es el uranio.
A) VFF
B) VFV
C) VVV
D) FVV
E) FFV
EJERCICIO 13 :
¿A qué periodo y grupo pertenece el 5927Co ?
A) 5 – IIIB
B) 4 – IIB
C) 4 – VIIIB
D) 5 – IB
E) 5 – IIIA
EJERCICIO 14 :
¿A qué periodo y grupo pertenece el tecnecio 9843Tc ?
A) 5 – VB
B) 5 – VIIB
C) 5 – IIA
D) 4 – VB
E) 4 – VIIB
EJERCICIO 15 :
¿A qué periodo y grupo pertenece el 5928Ni ?
A) 3 – VIIIB
B) 3 – VIIIA
C) 4 – VIIB
D) 4 – IB
E) 4 – VIIIB
EJERCICIO 16 :
¿A qué periodo y grupo pertenece el 5123V ?
A) 5 – IIIA
B) 5 – VA
C) 3 – IIIB
D) 3 – VB
E) 4 – VB
EJERCICIO 17 :
¿A qué período y grupo pertenece el 3115P ?
A) 3 – IA
B) 3 – IIIA
C) 3 – VA
D) 4 – IA
E) 4 – IIIA
EJERCICIO 18 :
¿A qué periodo y grupo pertenece el 3416S ?
A) 3 – IVA
B) 4 – VIA
C) 3 – IVB
D) 3 – VIA
E) 3 – VIB
EJERCICIO 19 :
Los elementos químicos en la tabla periódica moderna se ordena por :
A) Número de masa.
B) Número atómico.
C) Electronegatividad.
D) Energía de ionización.
E) Radio atómico.
EJERCICIO 20 :
Con respecto a los siguiente elementos :
11R 19T
I) Ambos pertenece al mismo grupo. ( )
II) Son metales alcalinos. ( )
III) Son elementos de transición. ( )
Es correcto afirmar :
A) I y II
B) I y III
C) II y III
D) I, II y III
E) Sólo I
EJERCICIO 21 :
Con respecto al 2412Mg; señala verdadero (V) o falso (F) según corresponda :
( ) Es un halógeno
( ) Es un elemento líquido
( ) es un elemento de transición.
A) FFF
B) VFF
C) VVF
D) VFV
E) FFV
EJERCICIO 22 :
¿A qué periodo y grupo pertenece el 6530Zn?
A) 4 – IB
B) 4 – IIB
C) 4 – IA
D) 4 – IIA
E) 4 – VIIIB
EJERCICIO 23 :
Los elementos químicos que se encuentran en grupos tipo B se denominan :
A) Metales
B) No metales
C) Representativos
D) De transición
E) Metaloides
PREGUNTA 24 :
Indica el momento magnético de un alcalino.
A) 1,73
B) 2,24
C) 1,41
D) 2,45
E) 3,37
EJERCICIO 25 :
Los elementos químicos en la tabla periódica moderna se clasifica por propiedades químicas en :
A) De transición y representativos.
B) Metales y no matéales.
C) Livianos y pesados.
D) Dúctiles y maleables.
E) Estables y radiactivos.
EJERCICIO 26 :
Indica el periodo de un elemento químico con carga nuclear 80.
A) 5
B) 6
C) 7
D) 4
E) 3
EJERCICIO 27 :
De acuerdo a la configuración electrónica en la tabla periódica moderna se observa las zonas.
A) s y p
B) s y d
C) s, p, d
D) s, d, f
E) s, p, d, f
EJERCICIO 28 :
Relaciona correctamente :
I) Hidrógeno : metal alcalino
II) Flúor : halógeno
III) Kriptón : gas noble.
A) I y II
B) II y III
C) I y III
D) Sólo II
E) Todas
EJERCICIO 29 :
Con respecto a la electronegatividad
I) Mide la tendencia de un elemento para perder un electrón.
II) En un periodo aumenta a medida que aumenta el número atómico.
III) En un grupo aumenta de abajo hacia arriba.
Son correctas :
A) Sólo I
B) Sólo II
C) Sólo III
D) I y II
E) II y III
EJERCICIO 30 :
¿Cuál es el grupo de un elemento químico con número atómico igual a 16?
A) IVA
B) VA
C) VIA
D) IVB
E) VIB
CLAVES – RESPUESTAS :
1)A 2)E 3)C 4)D 5)B 6)D 7)A 8)B 9)B 10)E 11)A 12)C 13)C 14)B 15)E 16)E 17)C 18)E 19)B 20)A 21)C 22)B 23)D 24)A 25)A 26)C 27)E 28)E 29)E 30)C
SEGUNDA PRACTICA
PREGUNTA 1 :
Un elemento químico presenta 20 orbitales llenos en su configuración.
¿A qué grupo pertenece?
A) VIIIB
B) VIIIA
C) VIB
D) VIA
E) VB
PREGUNTA 2 :
Un elemento químico se encuentra en el quinto periodo y grupo VIIA.
¿Cuál es su carga nuclear?
A) 35
B) 53
C) 85
D) 48
E) 82
PREGUNTA 3 :
Un elemento químico posee tres electrones en el subnivel más energético del tercer nivel de su configuración. Indica su periodo y grupo.
A) 3, IIIA
B) 3, VA
C) 4, IIIB
D) 4, VB
E) 5, VB
PREGUNTA 4 :
Si un halógeno libera una partícula alfa se convierte en :
A) Anfígeno
B) Nitrogenoide
C) Carbonoide
D) Gas noble
E) Alcalino
PREGUNTA 5 :
Señala los números cuánticos del último electrón en la configuración de un alcalino térreo del 4to período.
A) 3, 1, 0, –1/2
B) 4,1, 0, +1/2
C) 4, 0, 0, –1/2
D) 3, 2, –2, +1/2
E) 4, 0, 0, +1/2
PREGUNTA 6 :
Indica el momento magnético de un alcalino térreo.
A) 2,8
B) 2,4
C) 3,2
D) 0,0
E) 1,0
PREGUNTA 7 :
Si la configuración electrónica de un elemento termina en “p” entonces es
A) Alcalino
B) Metal de transición
C) Representativo
D) Alcalino térreo
E) De transición interna
PREGUNTA 8 :
Los elementos que se ubican en grupos tipo B se consideran :
A) Metales representativos
B) No metales
C) Metales de transición
D) Gases nobles
E) Alcalinos
PREGUNTA 9 :
Un elemento químico posee 2 isótopos cuyos números de masa son 54 y 56 respectivamente y presentan en total 52 neutrones.
¿En qué grupo de la tabla periódica moderna se ubica?
A) IB
B) IIB
C) IIIB
D) IVB
E) VB
PREGUNTA 10 :
A las hileras horizontales en un sistema periódico se llama :
A) Periodo
B) Grupo
C) Energía
D) Carga nuclear
E) Número másico
PREGUNTA 11 :
Señala un metaloide :
A) Aluminio
B) Galio
C) Estaño
D) Bismuto
E) Antimonio
PREGUNTA 12 :
Si la configuración electrónica de un elemento termina en “f” entonces es
A) Anfígeno
B) Halógeno
C) De transición
D) Lantánido
E) Representativo
PREGUNTA 13 :
Indica el periodo de un elemento con Z=30.
A) 2
B) 3
C) 4
D) 5
E) 6
PREGUNTA 14 :
Señala a un calcógeno :
A) Calcio
B) Cinc
C) Cadmio
D) Azufre
E) Bromo
PREGUNTA 15 :
Indica un alcalino:
A) Cobre
B) Hierro
C) Rubidio
D) Bario
E) Cinc
PREGUNTA 16 :
Un elemento químico se encuentra en el grupo IA y periodo =6.
¿Cuál es su número atómico?
A) 37
B) 55
C) 17
D) 79
E) 87
PREGUNTA 17 :
Señala periodo y grupo de un elemento químico con Z=24.
A) Período = 3 ; Grupo = IVB
B) Período = 4 ; Grupo = VB
C) Periodo = 4 ; Grupo = VIB
D) Periodo = 3 ; Grupo = VIA
E) Periodo = 4 ; Grupo = IVB
PREGUNTA 18 :
¿Cuál es el grupo de un elemento cuyo Z=29?
A) VB
B) VIB
C) VIIIB
D) IB
E) IIB
PREGUNTA 19 :
Un elemento químico presenta 11 electrones en el tercer nivel de su configuración. Indica el grupo al que pertenece dicho elemento.
A) VB
B) IVB
C) IIIB
D) IIIB
E) VA
PREGUNTA 20 :
Si un halógeno emite una partícula beta se convierte en :
A) Anfígeno
B) Carbonoide
C) Gas noble
D) Halógeno
E) Alcalino
CLAVES – RESPUESTAS :
1)A 2)B 3)A 4)B 5)E 6)B 7)C 8)C 9)A 10)A 11)E 12)D 13)C 14)D 15)C 16)B 17)C 18)D 19)A 20)C
PRACTICA PROPUESTA
PROBLEMA 1 :
La Tabla Periódica es un sistema que ordena los elementos químicos, dicho ordenamiento guarda una gran información que puede ser aprovechada en cualquier campo de la química.
Al respecto, indique el valor de verdad (V o F) de las siguientes proposiciones:
I) Moseley diseñó la tabla periódica en función periódica de la masa atómica.
II) Los elementos ubicados en un mismo periodo tienen propiedades similares.
III) Según la IUPAC, presenta 18 grupos y 7 periodos.
A) FFV
B) VFV
C) VVV
D) FVF
E) FVV
Rpta. : "A"
PROBLEMA 2 :
En 1791, William Gregor descubrió un elemento químico desconocido en un mineral que había encontrado. Poco después, en 1795, el químico Martín Kalprotz, le dio a este elemento el nombre de titanio en referencia a los titanes de la mitología griega. Este elemento contiene 22 protones en su núcleo, posee baja densidad, cualidad que ha sido aprovechada para el diseño de bicicletas de carrera, prótesis de huesos y cartílagos en cirugías.
Con respecto al titanio, seleccione el valor de verdad (V o F) de las siguientes proposiciones.
I) Es capaz de conducir la corriente eléctrica.
II) Posee 4 electrones de valencia.
III) Pertenece al periodo 4 y grupo IVB (4) de la Tabla Periódica.
A) FFV
B) VFV
C) VVV
D) FVV
E) FVF
Rpta. : "C"
PROBLEMA 3 :
Los oligoelementos son elementos presentes en pequeñas cantidades, son imprescindibles para los organismos vivos ya que cumplen diversas funciones. Entre ellos tenemos al magnesio (Z=12) que participa en la síntesis de proteínas, y otros como el selenio (Z=34) que protege al organismo de los radicales libres. Respecto a la ubicación en la Tabla Periódica de los elementos mencionados, indique el valor de verdad (V o F) para las siguientes proposiciones.
I) El 12Mg pertenece a la familia de los metales alcalinos (IA).
II) El 12Mg es un elemento que se encuentra en el bloque s.
III) El 34Se y el 12Mg se ubican en el mismo periodo.
IV) El 34Se pertenece al grupo VIA (6).
A) VFVV
B) VVVV
C) FVFF
D) FVVF
E) VVFF
Rpta. : "C"
PROBLEMA 4 :
Existe cierto elemento que forma parte de la constitución de los huesos y los dientes junto con el fósforo y la vitamina D, además ayuda a que la sangre circule a través de los vasos sanguíneos. Si los números cuánticos para su ultimo electrón del átomo de dicho elemento son (4, 0, 0, –1/2).
Determine el periodo y grupo al que pertenece dicho elemento.
A) 4, IIA (12)
B) 3, IIA (2)
C) 4, IIA (2)
D) 3, IA (1)
E) 4, IA (1)
Rpta. : "C"
PREGUNTA 5 :
El zinc es un elemento que tiene su nivel 3 completo y contiene solo 12 electrones en ℓ=1 y 8 electrones en los subniveles ns. Es un oligoelemento que se encuentra en el organismo, en segundo lugar, de concentración después del hierro. Es necesario para que el sistema inmunitario del cuerpo funcione apropiadamente, participa en la división y el crecimiento de las células, al igual que en la cicatrización de heridas y en el metabolismo de los carbohidratos.
Con respecto al elemento indique respectivamente, el número atómico, el periodo y grupo al cual pertenece en la Tabla Periódica.
A) 30 – 3 – II B (12)
B) 30 – 3 – II B (2)
C) 31 – 4 – II B (12)
D) 32 – 4 – II A (2)
E) 30 – 4 – II B (12)
Rpta. : "E"
PROBLEMA 6 :
El yodo (53I) es necesario para que las células transformen los alimentos en energía. Los seres humanos necesitan el yodo para el funcionamiento normal de la tiroides y para la producción de las hormonas tiroideas.
Con respecto a dicho elemento seleccione el valor de verdad (V o F) de las siguientes proposiciones:
I) Presenta mayor electronegatividad que el oxígeno (Z=8).
II) Su radio atómico es mayor que la del rubidio (Z=37).
III) Presenta menor afinidad electrónica que el cloro (Z=17).
A) FFV
B) VFV
C) VVV
D) FVV
E) VVF
Rpta. : "A"
PROBLEMA 7 :
El cuerpo utiliza el hierro para fabricar la hemoglobina, una proteína de los glóbulos rojos que transporta el oxígeno de los pulmones a distintas partes del cuerpo, dicha proteína se encuentra formada por el hierro en su forma de catión divalente, cuyo último electrón presenta los números cuánticos (3, 2, –2, –½).
Indique a qué periodo y grupo de la Tabla Periódica corresponde dicho elemento.
A) 4, VIII A (8)
B) 4, VIII B (10)
C) 4, VIIIB (8)
D) 3, VIII A (8)
E) 3, VIII B (8)
Rpta. : "C"
PROBLEMA 8 :
El molibdeno es un oligoelemento esencial para casi todas las formas de vida. El cuerpo humano contiene aproximadamente unos 9 mg de molibdeno. Su concentración en los tejidos y líquidos corporales es baja, aunque las mayores cantidades se encuentran en los riñones, el hígado, el intestino delgado y las glándulas suprarrenales, formando parte en su mayoría de enzimas.
Si la configuración electrónica de su catión trivalente termina en 4d³, ubique el periodo y grupo, respectivamente, al que pertenece dicho elemento.
A) Periodo 4 y grupo IIB (2)
B) Periodo 4 y grupo VB (5)
C) Periodo 5 y grupo VIB (6)
D) Periodo 5 y grupo IVB (4)
E) Periodo 5 y grupo VB (15)
Rpta. : "C"
PROBLEMA 9 :
Las propiedades periódicas son aquellas que presentan los átomos de un elemento y que varían en la Tabla Periódica según su ubicación en los grupos y periodos de esta.
Seleccione la alternativa que represente correctamente la relación propiedad periódica – definición.
a) Afinidad electrónica
b) Energía de ionización
c) Electronegatividad
( ) Energía para perder un 𝑒– en estado gaseoso.
( ) Capacidad de un átomo de atraer 𝑒– hacia sí.
( ) Energía para aceptar un 𝑒– en el estado gaseoso.
A) bca
B) abc
C) cba
D) bac
E) cab
Rpta. : "A"
PROBLEMA 10 :
El cloro (Z=17) es un gas tóxico de color verdoso, causa irritación a los ojos y vías respiratorias, dichas características fueron aprovechadas en la Primera Guerra Mundial, donde fue empleada como la primera arma química durante el conflicto bélico.
Con respecto a las propiedades periódicas de dicho elemento, indique cuáles de las siguientes proposiciones son correctas.
I) Tiene mayor afinidad electrónica que el sodio (11Na).
II) Tiene mayor energía de ionización que el iodo (53I).
III) Tiene menor electronegatividad que el flúor (9F).
A) Solo I
B) Solo II
C) Solo III
B) Solo II y III
E) I, II y III
Rpta. : "E"
PROBLEMA 11 :
Por medio del radio atómico, es posible determinar, aproximadamente, el tamaño del átomo. Dependiendo del tipo de elemento, existen diferentes técnicas para su determinación como la difracción de neutrones, de electrones o de rayos X.
Al respecto, indique el valor de verdad (V o F) de las siguientes proposiciones:
I) Se define como la distancia del núcleo hacia el mayor nivel de energía de un átomo.
II) Para el radio del anión del cloro, se cumple que: R. Cℓ1– < R. Cℓ.
III) Para el radio del catión del hierro, se cumple que: R. Fe3+ < R. Fe2+ < R. Fe
A) VVV
B) FFV
C) FVF
D) VFV
E) FVV
Rpta. : "B"
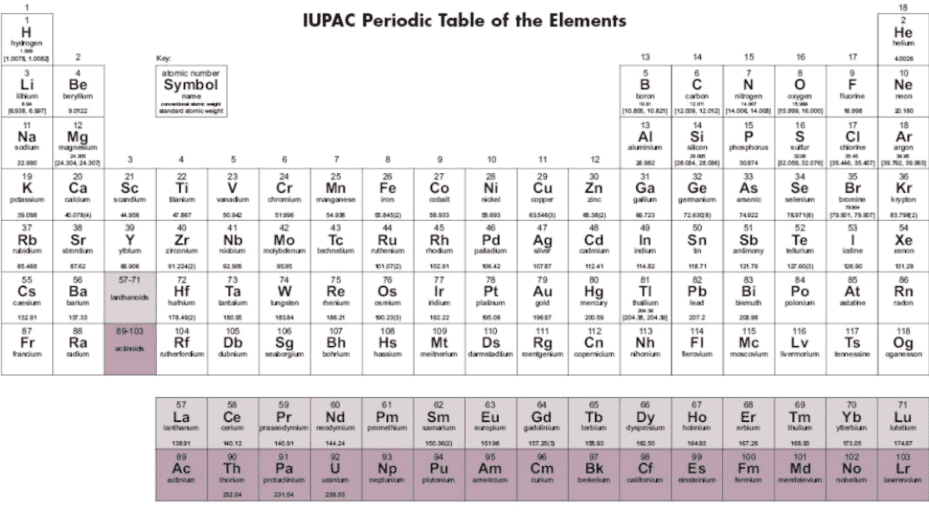
¿QUÉ ES LA TABLA PERIÓDICA?
La Tabla periódica es una clasificación de los elementos químicos en función de alguna característica o propiedad.
Debido a la presencia de los elementos en los compuestos orgánicos e inorgánicos fue necesario clasificarlos y ordenarlos.
Hagamos un poco de historia A principios del siglo XIX aparecieron los primeros intentos de clasificación de los elementos, entre los que destacan los siguientes:
JACOB BERZELIUS(1813)
Clasificó a los elementos conocidos en electropositivos y electronegativos.
Electropositivos (metales) ↔ Pierden electrones
Electronegativos (No metales) ↔ Gana electrones
JUAN WOLFANG DOBEREINER (ALEMÁN 1829) “TRÍADAS”
☛ Señaló por primera vez la existencia de una relación significativa entre las propiedades de los elementos y sus respectivas masas atómicas relativas.
☛ Clasifica a los elementos en grupos de a 3 (Tríadas).
☛ Ordena de forma creciente a su peso atómico.
☛ El peso atómico central era el promedio de los pesos atómicos de los otros dos.
☛ Estableció 20 tríadas.
TORNILLO TELÚRICO DE CHANCOURTOIS (1862)
Propone una clasificación periódica de los elementos en forma de hélice que llamó caracol telúrico. En un cilindro trazó una hélice con un ángulo de elevación de 45° sobre la base y en ella fue colocando los elementos en función creciente a sus pesos atómicos, de tal manera que la línea vertical del cilindro intercepta a los elementos con propiedades semejantes.
JHON A. NEWLANDS (INGLÉS 1865) “OCTAVAS”
☛ Descubrió una sorprendente regularidad al ordenar los elementos entonces conocidos según el orden creciente de sus respectivas masas atómicas.
☛ Clasifica a los elementos en grupos de 7, de tal manera que el octavo elemento tenía propiedades similares al primero (Octavas).
☛ Ordena los elementos de forma creciente al peso atómico.
DIMITRI I. MENDELÉIEV (RUSO 1869) Y LOTHAR MEYER (INGLÉS 1869)
Mendeléiev: “Padre de la tabla”
☛ Realiza una tabla y ordena en forma más completa a los elementos basado en las propiedades químicas, como función de la masa atómica.
☛ Meyer propuso una clasificación análoga a la de Mendeléiev, considerando las propiedades físicas también como función de las masas atómicas relativas.
☛ Mendeléiev clasifica los 63 elementos en base a 7 periodos y 8 grupos , además tenía espacios vacíos para elementos aún no descubiertos a los que denominó EKA y de los cuales predijo sus propiedades.
“Las propiedades de los elementos químicos están en función periódica de sus pesos atómicos” (orden creciente de sus pesos atómicos). Mendeléiev diseñó la primera Tabla periódica, se le denominó Tabla periódica porque el ordenamiento está basado en la variación periódica de las propiedades de los elementos. Trabajo similar realizó Lothar Meyer quien consideró a la propiedad física como función del peso atómico.
DESVENTAJAS DE LA TABLA DE MENDELEIEV
☛ El H no tiene un lugar fijo en la tabla.
☛ No hay zonas diferenciadas en la tabla para metales y no metales pues están juntos según ubicación.
☛ Hay anomalía en el orden creciente al peso atómico (P.A.)
☛ La tabla sólo destaca una valencia para los elementos.
HENRY MOSELEY(1914) (Ley periódica actual)
al "Z" propone: "las propiedades de los elementos son función periódica del número atómico (Z)". De esta forma al tomar en cuenta el "Z" se corrige la anomalía 3 de Mendeleiev.
TABLA PERIÓDICA ACTUAL
Fue diseñada por el químico alemán J. Werner, en base a la ley de Moseley y la distribución electrónica de los elementos. Además tomó como referencia la Tabla de Mendeléiev.
CLASIFICACIÓN DE LOS ELEMENTOS
Los elementos en la tabla periódica se clasifican en metales, no metales y metaloides.
PROPIEDADES DE LOS ELEMENTOS
FÍSICAS
☛ Los metales se encuentran al estado sólido a excepción del Hg.
Los no metales pueden ser sólidos (carbono), líquidos (bromo) o gaseosos (oxígeno).
☛ Los metales presentan brillo característico y son opacos.
Los no metales no tienen brillo y por lo general son transparentes.
☛ Los metales son buenos conductores del calor y la corriente eléctrica.
Los no metales son malos conductores.
QUÍMICAS
☛ Los metales presentan pocos electrones de valencia.
Los no metales presentan muchos electrones de valencia.
☛ Los metales tienen la facilidad de perder electrones formando cationes.
Los no metales tienen la facilidad de ganar electrones formando aniones.
Los metaloides se ubican en el límite entre metales y no metales.
Presentan un comportamiento intermedio entre metales y no metales influenciando para ello la temperatura (por esa razón se les utiliza en la fabricación de transistores).
DESCRIPCIÓN DE LA TABLA
☛ Los 118 elementos que reconoce la IUPAC están ordenados en orden creciente a sus números atómicos.
☛ Presenta cuatro zonas bien definidas.
☛ Presenta siete filas horizontales (periodos).
☛ Presenta 18 columnas verticales (grupos).
FAMILIA A (ELEMENTOS REPRESENTATIVOS)
está formado por los elementos que, en su configuración electrónica, terminan en un subnivel s o p .
☛ Excepto el Hidrógeno (Z=1) cuya configuración electrónica es 1s1
☛ La configuración electrónica del Helio (Z=2) es 1s2
FAMILIA B : ELEMENTOS DE TRANSICIÓN
Está formado por los elementos que en su configuración terminan en un subnivel "d".
PROPIEDADES PERIÓDICAS DE LOS ELEMENTOS
Determinado número de propiedades de los átomos muestran una variación periódica con el número atómico.
A continuación se muestran las propiedades más importantes:
☛ El punto de fusión
☛ El punto de ebullición
☛ La densidad
☛ La conductividad eléctrica
☛ La capacidad para combinarse con otros elementos
☛ El radio atómico
☛ El potencial de ionización
☛ La afinidad electrónica
☛ La electronegatividad
ELECTRONEGATIVIDAD (E.N.)
Es la capacidad que presentan los átomos para atraer electrones en un enlace.
La electronegatividad de los elementos se expresa en unidad de energía según Linus Pauling.
☛ En un periodo aumenta de izquierda a derecha.
☛ En un grupo disminuye de arriba hacia abajo.
La electronegatividad es la tendencia que tiene un átomo de atraer hacia sí los electrones de otro átomo cuando se forma un enlace químico.
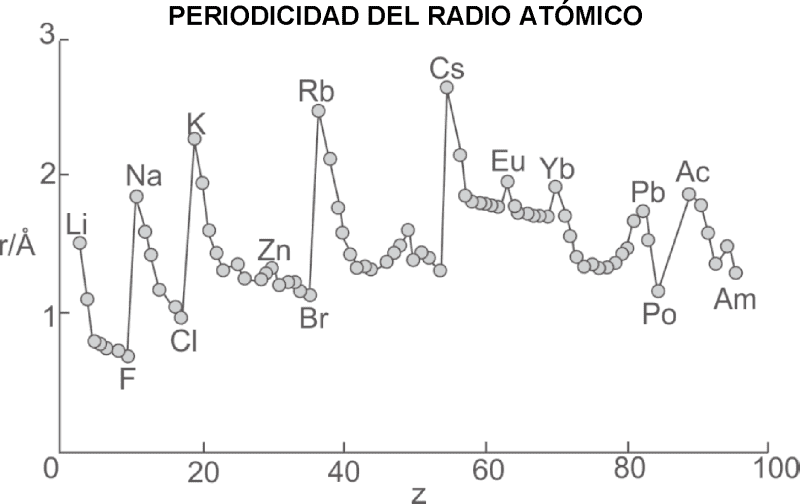
EL RADIO ATÓMICO (TAMAÑO ATÓMICO)
Es la mitad de la distancia internuclear de dos átomos. Por medio del radio atómico es posible determinar el tamaño de los átomos.
☛ En un periodo, el radio atómico disminuye de izquierda a derecha, al aumentar el número atómico.
☛ En un grupo, el radio atómico se incrementa al aumentar el número atómico. En caso de elementos no metálicos diatómicos (H2, Cℓ2, I2, Br2, etc.), el radio atómico se llama radio covalente, que es la mitad de la distancia internuclear. En general, el radio atómico nos proporciona el tamaño relativo del átomo. - En el primer periodo se presenta una anomalía por que:
R.A.(H)<R.A.(He)
POTENCIAL O ENERGÍA DE IONIZACIÓN
Es la energía necesaria para “arrancar” un electrón de un átomo neutro.
De esta manera el átomo se convierte en un ión positivo o catión.
☛ A menor radio atómico mayor energía de ionización y por el contrario a mayor radio atómico menor es la energía de ionización.
☛ En la tabla periódica la energía de ionización varía
☛ En un periodo, aumenta de izquierda a derecha como consecuencia del aumento de “Z”.
☛ En un grupo, disminuye de arriba a abajo a aumentar “Z”.
AFINIDAD ELECTRÓNICA O ELECTROAFINIDAD (A.E.)
Igual como ocurre la ionización para originar un catión, la formación de un anión también requiere de energía. Se denomina afinidad electrónica a la cantidad de energía que se libera cuando un átomo neutro gana un electrón y se convierte en ión negativo o anión.
La afinidad electrónica puede considerarse como el inverso del potencial de ionización.
☛ En un periodo aumenta de izquierda a derecha al aumentar Z .
☛ En un grupo disminuye de arriba hacia abajo al aumentar Z .
☛ El máximo valor de afinidad electrónica lo tiene el cloro.
☛ Los gases nobles tienen baja A.E., esto se debe a que estos elementos tienen los subniveles externos s y p llenos, no tienen tendencia a aceptar electrones.
PROPIEDADES GENERALES DE LOS METALES Y LOS NO METALES METALES
☛ Son opacos a la luz y presentan brillo metálico; su coloración varía en tonalidades de gris, excepto el cobre que es rojizo y el oro que es amarillo.
☛ Los sólidos son maleables y dúctiles
☛ Son buenos conductores del calor y la electricidad.
La plata es el mejor conductor de la electricidad, seguida del cobre y el oro.
☛ Tienden a oxidarse (son agentes reductores) para formar cationes.
☛ A 25°C son sólidos, excepto el mercurio, que es líquido a temperatura ambiente.
☛ Sus puntos de fusión y ebullición son variables desde relativamente bajos, hasta relativamente altos.
☛ Presentan elevadas densidades.
NO METALES
☛ Los sólidos suelen ser quebradizos, con una escala de dureza variable.
☛ Son malos conductores del calor y la electricidad (buenos aislantes).
☛ Tienden a reducirse (agente oxidantes) para formar aniones.
☛ Los no metales tienen bajos puntos de fusión y ebullición.
☛ Sus estados de agregación a 25°C:
¿Para dominar química me debo aprender toda la tabla, será suficiente memorizar los símbolos y número atómico o también debo aprender todos los demás códigos ?
No es necesario para ninguna universidad o sea a lo que me refiero es que para ninguna universidad para postular es necesario que te aprendas el número atómico por que ahora viene como dato en los problemas ya sea san marcos o UNI y en la UNI ya es fijo que viene como dato .
Lo que mi profesor quería es que aprendamos específicamente en donde y en que parte se encuentra cada elemento eso quiere decir que quería que aprenda la carga nuclear (Z) incluyendo su estados de oxidación(E.O.) , el problema era el tiempo esa nota de memorizar no es al toque y demora mucho , en experiencia personal cuando veas un ELEMENTO químico trates de identificar el "NOMBRE" y algunos elementos que si te tienes que memorizar son los gases nobles obviamente por que son fijos que usarás en la Configuración electrónica, en el caso de E.O. igual son solo algunos elemento pero para este caso ya ni siquiera es necesario memorizar por que viene como dato en el problema .
conclusión:
No es necesario memorizar la tabla periódica para ser un crack en química , hablando eso hasta los propios universitarios químicos puros no se saben toda la tabla más bien tiene un poster de la tabla periódica y cuando se les olvida algo miran dicho poster.
Aprende los nombre de los elementos con problemas eso si no demora o trata de identificar que cosa es si es un metal o un no metal o un gas etc. Aunque para eso también hay teoría para que no memorices nada .
No te explote con química te puede desmotivar mucho .










.png)