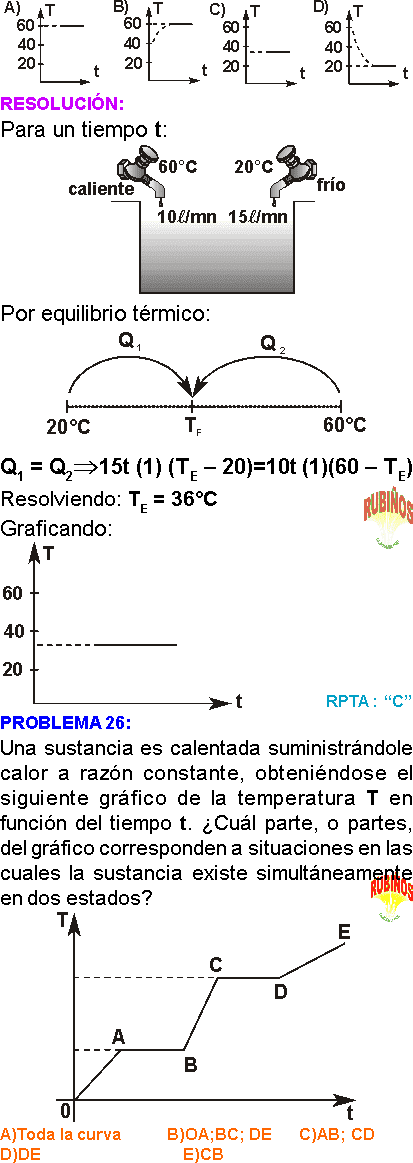
CALORIMETRÍA EJERCICIOS RESUELTOS PDF
Como se sabe, la temperatura del cuerpo humano normalmente se mantiene en unos 36°C, mientras que la del ambiente es, en general, menor que el valor.
Por este motivo, hay una continua transmisión de calor de nuestro cuerpo hacia el medio circundante.
Si la temperatura de éste se mantiene baja, dicha transmisión se efectúa con mayor rapidez, y esto nos provoca la sensación de frío.
- CLIC AQUÍ Ver CALOR SENSIBLE – CALORIMETRÍA 1 RESUELTA – CemATA
- Ver EQUILIBRIO TÉRMICO – CALORIMETRÍA 2
- Ver CAMBIO DE FASE – CALORIMETRÍA 3
- Ver TRANSFERENCIA DE CALOR – CALORIMETRÍA 4
¿Qué es la Calorimetría ?
La calorimetría es la ciencia encargada de las mediciones del calor que transfieren los cuerpos en aquellos fenómenos donde juega un papel importante la temperatura.
Las prendas de abrigo atenúan esta sensación porque están hechas de materiales aislantes térmicos (por ejemplo, la lana), y reducen así la cantidad de calor que se transmite de nuestro cuerpo al exterior.
A ello se debe que para obtener este mismo efecto, las aves erizan sus plumas en los días de frío, a fin de mantenerse.
EJERCICIO 1
Con respecto a las propiedades térmicas de los materiales, determine las proposiciones verdaderas (V) o falsas (F).
I. La capacidad calorífica de un cuerpo no depende de su masa.
II. El calor especifico depende de la sustancia o material del que este hecho el cuerpo.
III. 20 g de agua tienen el doble de capacidad calorífica que 10 g de agua.
A) VVV
B) FFF
C) VVF
D) VFV
E) FVV
EJERCICIO 2
Con respecto al concepto de calor, determine las proposiciones verdaderas (V) o falsas (F) y marque la secuencia correcta:
I. Es una forma de energía acumulable en un cuerpo.
II. Es la energía en transferencia de un cuerpo a otro en contacto térmico y a distintas temperaturas.
III. Un cuerpo a mayor temperatura tiene más calor que un cuerpo a menor temperatura.
A) VVV
B) FVF
C) VFV
D) FVV
E) VVF
EJERCICIO 3
Respecto al concepto de calor se dan las siguientes proposiciones:
I. En forma espontánea el calor va de un cuerpo de menor temperatura a otro de mayor temperatura.
II. La transferencia de calor entre dos cuerpos ocurre solamente si están en contacto físico.
III. Existe contacto térmico entre dos o más cuerpos si puede haber transferencia de calor entre ellos. ¿Cuáles son correctas?
A) I
B) II
C) III
D) I y II
E) I y III
PRIMERA PRACTICA
PREGUNTA 1 :
A cierto bloque de cierto metal con (Ce=0,5) se le entregó 150 calorías y termino a 40°C.
¿A qué temperatura se encontraba inicialmente si el bloque tiene 10g de masa?
A) 10°C
B) 20°C
C) 30°C
D) 35°C
E) 40°C
PREGUNTA 2 :
En un problema anterior. ¿Cuál es la capacidad calorífica del bloque?
A) 1
B) 2
C) 3
D) 4
E) 5
PREGUNTA 3 :
Si en el problema anterior al bloque se le hubiera dado el doble de calor, entonces
¿A qué temperatura habría terminado?
A) 80°C
B) 70°C
C) 60°C
D) 50°C
E) 40°C
PREGUNTA 4 :
Se tienen dos cuerpos (A) y (B) de la misma sustancia, pero mA= 2mB. Entonces si queremos que los dos experimenten el mismo calentamiento.
¿En que relación estarán los calores que se les tiene que dar?
A) 1
B) 2
C) 3
D) 4
E) 5
PREGUNTA 5 :
Dos cuerpos que están en las temperaturas de 30°C y 70°C se les pone en contacto y llegan a una temperatura final de equilibrio T.
Entonces:
I. T es mayor a 30°.
II. T es mayor a 70°.
III. T es menor a 30°.
IV. T es menor a 70°.
¿Cuántas afirmaciones son correctas?
A) 1
B) 2
C) 3
D) 4
E) 5
PREGUNTA 6 :
Se mezclan 100g de agua a 10°C con 300g de agua a 90°C.
¿A qué temperatura terminara la mezcla?
A) 50°C
B) 60°C
C) 70°C
D) 80°C
E) 90°C
PREGUNTA 7 :
En el problema anterior, ¿en qué relación estarán las capacidades caloríficas de (A) y (B)?
A) 1
B) 2
C) 3
D) 4
E) 5
PREGUNTA 8 :
En el problema anterior, si hubieras usado 100g menos del agua a 45°C, ¿Cuál hubiera sido la nueva temperatura final de la mezcla?
A) 20°C
B) 21°C
C) 22°C
D) 23°C
E) 24°C
PREGUNTA 9 :
Se mezclan 400g de agua a 15°C con 200g de agua a 45°C. ¿Cuál será la temperatura final de la mezcla?
A) 20°C
B) 25°C
C) 30°C
D) 35°C
E) 40°C
PREGUNTA 10 :
Se mezcla agua en cantidades de 200g, 100g y 50g a las temperaturas de 20°C, 50°C y 100°C, respectivamente. ¿Cuál será la?
A) 10°C
B) 20°C
C) 30°C
D) 40°C
E) 41°C
PREGUNTA 11 :
En un calorímetro de equivalente en agua 60g que contiene 20g de agua a 15°C se vierte 70g de agua a 30°C. ¿Cuál será la temperatura final de la mezcla?
A) 20°C
B) 21°C
C) 22°C
D) 23°C
E) 40°C
PREGUNTA 12 :
Se mezcla 200g de agua a 4°C con 50g de agua a 19°C y 400g de cierta sustancia “x” a 25°C. Si el calor específico de la sustancia “x” es 0,5. ¿Cuál será la temperatura final de la mezcla?
A) 10°C
B) 15°C
C) 20°C
D) 25°C
E) 30°C
PREGUNTA 13 :
Se coloca un trozo de metal a 80°C, (Ce= 0,4) sobre 200 gramos de agua a 30°C, si al final la temperatura del agua es de 40°C, halla la masa del metal.
A) 150g
B) 125g
C) 100g
D) 75g
E) 50g
PREGUNTA 14 :
Se mezcla 80g de agua a 10°C con 15 gramos de cierta sustancia a 80°C, terminando la mezcla a una temperatura de 40°C. ¿Cuál es el calor específico de la sustancia?
A) 2
B) 3
C) 4
D) 5
E) 8
PREGUNTA 15 :
Se mezcla agua en cantidades de 200g , 100g y 50g a las temperaturas de 20°C, 50°C y 100°C, respectivamente.
¿Cuál será la temperatura final de la mezcla?
A) 10°C
B) 20°C
C) 30°C
D) 40°C
E) 42°C
PREGUNTA 16 :
En un calorímetro de equivalente en agua 80g que esta a 0°C se vierte 16g de agua a 60°C. ¿Cuál será la temperatura final de equilibrio?
A) 10°C
B) 20°C
C) 30°C
D) 40°C
E) 45°C
PREGUNTA 17 :
En un calorímetro de equivalente en agua 50g que contiene 50g de agua a 10°C se echa un bloque de metal de 400g a 100°C (Cemetal= 0,5) ¿Cuál será la temperatura final de la mezcla?
A) 80°C
B) 70°C
C) 60°C
D) 50°C
E) 40°C
CLAVES – RESPUESTAS : 1)A 2)E 3)B 4)B 5)B 6)C 7)B 8)B 9)B 10)C 11)C 12)B 13)B 14)* 15)D 16)A 17)B
SEGUNDA PRACTICA
PREGUNTA 1 :
En un recipiente de capacidad calorífica despreciable se mezclan 300g de agua a 25°C con 700gr. de agua a 85°C. Determina la temperatura final de la mezcla.
A) 60°C
B) 70°C
C) 67°C
D) 61°C
E) 55°C
PREGUNTA 2 :
¿Qué cantidad de agua podría reemplazar a un recipiente de 1kg y calor específico igual a 0,3g cal/gºC, experimentando los mismos cambios de temperatura?
A) 175g
B) 1900g
C) 800g
D) 600g
E) 300g
PREGUNTA 3 :
Se dispone de un calorímetro cuyo equivalente en agua es de 20 g y contiene 200g de agua a 17°C. Se introduce en el calorímetro una pieza de metal de 250gr. a 86°C y se logra una temperatura de equilibrio de 20°C. Determina el calor específico del metal en cal/g°C.
A) 0,04
B) 0,08
C) 0,02
D) 0,07
E) 0,05
PREGUNTA 4 :
Calcula la temperatura de equilibrio de la mezcla de 150gr. de agua líquida a 30°C con 200g de agua líquida a 80°C que se encuentra en un depósito de capacidad calorífica igual a 50 cal/°C.
A) 55°C
B) 42°C
C) 42,5°C
D) 60,5°C
E) 61,25°C
PREGUNTA 5 :
Se tienen 0,4 litros de agua a 80ºC en un recipiente de capacidad térmica despreciable.
¿Qué cantidad de masa de agua a 20ºC se requiere mezclar con la anterior para obtener agua a 30ºC?
A) 3kg
B) 8kg
C) 5kg
D) 2kg
E) 15kg
PREGUNTA 6 :
En un calorímetro de equivalente en H2O igual a 20g Se tiene 480g de agua a una temperatura inicial de 18°C. Si se introduce un bloque metálico de 600g . A la temperatura inicial de 100°C, se logra una temperatura final de equilibrio de 20°C. Determina el Ce del metal.
A) 0,02
B) 0,03
C) 0,04
D) 0,05
E) 0,07
PREGUNTA 7 :
Se tiene un calorímetro de cobre de 200g de masa y Ce igual a 0,09 que contiene 282g de H2O inicialmente a 25°C. Si se introduce un bloque de plomo de 0,5kg. de Ce=0,03 y a la temperatura inicial de 150°C. Calcula la temperatura final de equilibrio.
A) 30 °C
B) 40 °C
C) 30,9 °C
D) 43,4 °C
E) N.A.
PREGUNTA 8 :
En un calorímetro de equivalente en agua despreciable se encuentra 1kg. de agua a 10°C. Se introduce `1kg. de cierto líquido a 52.5°C y un cuerpo de 2kg. (Ce=1,5 cal/g°C) a 40° y se alcanza una temp. final de 42,5°C. Determina el calor específico del líquido en cal/g°C.
A) 2
B) 4
C) 6
D) 8
E) 12
PREGUNTA 9 :
En un calorímetro de 4 Cal/ºC de capacidad térmica, se tiene 20cm³ de agua a 20ºC. Si al sistema anterior se le introduce 50g de un mineral desconocido cuya temperatura es de 140ºC, se observa que la temperatura final de la mezcla es de 60ºC. Halla el calor específico de dicho mineral en Cal/gºC.
A) 2,4
B) 0,024
C) 0,24
D) 0,48
E) 0,048
PREGUNTA 10 :
Determina el calor que reciben 10g de hielo, en su punto de fusión, para obtener agua a 80°C.
A) 1500 cal
B) 1200 cal
C) 1600 cal
D) 800 cal
E) 900 cal
PREGUNTA 11 :
Determina el calor que se le debe entregar a 20g de hielo a –5°C para que alcance su punto de fusión.
A) 50 cal
B) 20 cal
C) 80 cal
D) 20 cal
E) 5 cal
PREGUNTA 12 :
En un calorímetro de equivalente en agua despreciable se tienen 100g de hielo mezclados en equilibrio con 200g de agua. Si se vierte en el calorímetro 20g de vapor de agua a 100ºC. Determina la temperatura de equilibrio.
A) 0ºC
B) 15ºC
C) 20ºC
D) 25ºC
E) 18ºC
PREGUNTA 13 :
Se desea fundir un bloque de hielo de 10kg. que se encuentra a –15°C de temperatura. Halla la mínima cantidad de agua a 87,5°C que se debe utilizar para fundir totalmente el bloque de hielo.
A) 7,5kg.
B) 8kg.
C) 12kg.
D) 10kg.
E) 15kg.
PREGUNTA 14 :
Se tiene 64kg. de hielo a 0°C. ¿Qué masa de vapor a 100°C habrá que hacer circular sobre el hielo para derretirlo?
A) 8kg.
B) 9kg.
C) 7kg.
D) 6kg.
E) 10kg.
PREGUNTA 15 :
Un recipiente que no absorbe calor contiene 60g de hielo a –20ºC, se introduce agua a 70ºC, observándose que la temperatura de la mezcla es de 10ºC. Determina la masa de agua que se utiliza.
A) 80g
B) 85g
C) 95g
D) 100g
E) 120g
PREGUNTA 16 :
Un calorímetro de capacidad calorífica despreciable en cuyo interior hay 100g de hielo a –10ºC si a éste sistema se le adiciona 25g de vapor a 100ºC. Calcula la temperatura final.
A) 81ºC
B) 72ºC
C) 40ºC
D) 48ºC
E) 60ºC
PREGUNTA 17 :
Un recipiente herméticamente cerrado y de equivalente en agua despreciable contiene 20g de hielo y 20g de agua, al sistema así en equilibrio se le introduce 120g de vapor de agua a 100ºC. Calcula la temperatura final de equilibrio.
A) 470ºC
B) 117,5ºC
C) 0ºC
D) 100ºC
E) Absurdo
PREGUNTA 18 :
Desde una altura de 40m., se suelta un bloque de hielo de 21kg. a 0ºC. Halla la cantidad de hielo que se derrite al impactar con el piso. Desprecia las pérdidas de energía al medio ambiente
(1 cal=4,2 J)
A) 24,5g
B) 20kg
C) 25,2g
D) 40g
E) 18,5g
PREGUNTA 19 :
Al mezclarse hielo a 0°C con agua a cierta temperatura se derriten “m” g. de hielo. Determina la temperatura inicial del agua sabiendo que si se hubieran agregado 20g. más de agua se habrían derretido 25g. más de hielo.
A) 50°C
B) 60°C
C) 80°C
D) 100°C
E) 160°C
PREGUNTA 20 :
En un recipiente de equivalente en agua despreciable, se tienen 500g de agua a 0°C. Si se introduce un cubo de hielo de 250g a 8°C, determina la masa de agua que se solidifica, cuando el sistema, alcanza el equilibrio térmico.
A) 0g
B) 25g
C) 5g
D) 10,5g
E) 12,5g
PREGUNTA 21 :
Un calorímetro de capacidad despreciable en cuyo interior hay 100g de hielo a –10ºC si a éste sistema se le adiciona 25g de vapor a 100ºC. Encuentra la temperatura final
A) 81ºC
B) 72ºC
C) 64ºC
D) 48ºC
E) 60ºC
PREGUNTA 22 :
En un recipiente de equivalente en agua despreciable, se tiene cierta cantidad de Hg inicialmente a 15ºC. Si se introduce una esfera de Pt a 120ºC se logra una temperatura de equilibrio de 40ºC. En un segundo caso el Hg se encuentra inicialmente a 20ºC. Calcula a que temperatura debe ingresar el Pt para lograr una temperatura de equilibrio de 50ºC.
A) 140ºC
B) 146ºC
C) 150ºC
D) 132ºC
E) 120ºC
PREGUNTA 23 :
Determina que cantidad de calor se requiere para poder vaporizar 50gr de hielo que se encuentra inicialmente a la temperatura de –10ºC si el calor especifico del hielo es 0,5 cal/g ºC.
A) 36250 cal
B) 40000 cal
C) 42340 cal
D) 32520 cal
E) 50000 cal
PREGUNTA 24 :
En un recipiente de equivalente en agua despreciable se tiene 0,5kg de hielo a 0ºC. Determina que masa de agua a 20ºC debe ingresar para lograr derretir exactamente todo el hielo.
A) 3000g
B) 4000g
C) 2000g
D) 1000g
E) 5000g
PREGUNTA 25 :
En un calorímetro de equivalente en agua igual a 20g , se encuentra en equilibrio 100g de hielo y 180g de agua. Si ingresan 20g de vapor a 100ºC. Determina la temperatura final de equilibrio.
A) 20ºC
B) 15ºC
C) 18ºC
D) 30ºC
E) 40ºC
CLAVES – RESPUESTAS : 1)C 2)E 3)A 4)A 5)D 6)A 7)C 8)B 9)D 10)B 11)A 12)A 13)D 14)A 15)D 16)C 17)D 18)C 19)A 20)D 21)E 22)B 23)A 24)C 25)B
TERCERA PRACTICA
PROBLEMA 1 :
Cuando juntamos 190 g de hielo a 0°C con m gramos de vapor de agua a 100°C la temperatura de equilibrio resulta 70°C. Determine m . Desprecie las pérdidas de energía.
A) 30 g
B) 40 g
C) 50 g
D) 70 g
E) 45 g
Rpta. : "C"
PROBLEMA 2 :
La cantidad de calor que se le entrega a 500g de agua inicialmente a 10°C depende del tiempo según Q=200t, donde t está en segundos y Q en calorías. Determine t en el instante que la temperatura del agua es 60°C?
A) 120 s
B) 130 s
C) 100 s
D) 125 s
E) 200 s
Rpta. : "D"
PROBLEMA 3 :
Se tiene dos cuerpos A y B de la misma masa, siendo el calor específico del primero CA , mayor que el del segundo CB . Los dos cuerpos están a la misma temperatura T> 0°C y se ponen en contacto con una gran masa de hielo. Escoja el enunciado correcto:
A) Los dos cuerpos no pierden calor.
B) Ambos cuerpos pierden la misma cantidad de calor.
C) El cuerpo A pierde más calor que el cuerpo B
D) El cuerpo A pierde menos calor que el cuerpo B
E) El cuerpo ‘‘A’’ gana calor y el cuerpo ‘‘B’’ pierde calor.
Rpta. : "C"
PROBLEMA 4 :
En una balanza de precisión se coloca un recipiente cerrado con un trozo de hielo y se le equilibra con pesas. Cuando el hielo se derrita formando agua:
A) Se mantiene el equilibrio.
B) Aumenta el peso.
C) Disminuye de peso.
D) El equilibrio depende de la pureza del agua.
E) El equilibrio depende del nuevo volumen.
Rpta. : "A"
PROBLEMA 5 :
¿Qué cantidad de agua se puede llevar al punto de ebullición (a presión atmosférica), consumiendo 3 kWh de energía? La temperatura inicial del agua es de 10°C. Se desprecian las perdidas de calor.
A) 28,7 kg
B) 286 g
C) 28,6 g
D) 57,2 g
E) 572 g
Rpta. : "A"
PROBLEMA 6 :
Si se observa que para elevar en 10°C la temperatura de un cuerpo de 200 g de masa se necesita 500 cal, su calor específico sería:
A) 2,5 cal/g×°C
B) 5,0
C) 0,25
D) 50
Rpta. : "C"
PROBLEMA 7 :
Dos cuerpos elevan su temperatura en la misma cantidad, pero para hacerlo, el primero requiere el doble de cantidad de calor que toma el segundo. ¿Cuánto es la relación entre el calor que toma el primer cuerpo y el que toma el segundo para que este cuerpo eleve su temperatura en una cantidad doble que el primero?
A) Cero
B) Uno
C) Dos
D) Uno y medio
Rpta. : "B"
PROBLEMA 8 :
Un recipiente que está térmicamente aislado contiene agua a 10°C. Se introduce en el 50 g de hielo (a 0°C) y se observa que el hielo no llega a fundirse completamente. ¿Cuántos gramos de agua había inicialmente en el recipiente? (calor latente de fusión del hielo: 80 cal/g).
A) 400
B) menos de 400
C) 500
Rpta. : "B"
PROBLEMA 9 :
En un día de verano, se tiene una jarra conteniendo limonada a la temperatura ambiente y se desea enfriarla a la temperatura más baja posible. ¿Cómo será más conveniente, introduciendo 25 g de hielo a 0°C o introduciendo 25 g de agua helada a 0°C?
A) 25 g de hielo a 0°C.
B) 25 g de agua helada a 0°C.
C) Cualquiera de los dos.
D) La decisión depende de la cantidad de limonada que se tenga.
E) La decisión depende de la temperatura a que se encuentre la limonada.
Rpta. : "A"
PROBLEMA 10 :
Las capacidades caloríficas específicas en cal/g°C de ciertas sustancias son: Aluminio 0,21; Hierro 0,11; Cobre 0,093; Plomo 0,031; Bronce 0,088. Si en un recipiente de uno de estos metales de masa 300g y a 98°C se vierte 15g de agua a 12,2°C. Se observa que la temperatura final del agua y el recipiente es 68°C. Diga Ud de qué metal está hecho el recipiente.
A) Aluminio
B) Hierro
C) Cobre
D) Bronce
E) Plomo
Rpta. : "C"
PROBLEMA 11 :
Un estudiante mezcla dos cantidades de un mismo fluido que están a diferentes temperaturas. La masa y la temperatura en grados Celsius de uno de ellos es el triple de fluido más frío, respectivamente. La temperatura inicial del fluido es 20°C. La temperatura de equilibrio de la mezcla es en (°C).
A) 20
B) 30
C) 40
D) 50
E) 60
Rpta. : "D"
PROBLEMA 12 :
En un día de verano, se tiene una jarra conteniendo limonada a la temperatura ambiente y se desea enfriarla a la temperatura más baja posible. ¿Cómo será más conveniente, introduciendo 25 g de hielo a 0°C o introduciendo 25 g de agua helada a 0°C?
A) 25 g de hielo a 0°C.
B) 25 g de agua helada a 0°C.
C) Cualquiera de los dos.
D) La decisión depende de la cantidad de limonada que se tenga.
E) La decisión depende de la temperatura a que se encuentre la limonada.
Rpta. : "A"
PROBLEMA 13 :
Las capacidades caloríficas específicas en cal/g°C de ciertas sustancias son: Aluminio 0,21; Hierro 0,11; Cobre 0,093; Plomo 0,031; Bronce 0,088. Si en un recipiente de uno de estos metales de masa 300g y a 98°C se vierte 15g de agua a 12,2°C. Se observa que la temperatura final del agua y el recipiente es 68°C. Diga Ud de qué metal está hecho el recipiente.
A) Aluminio
B) Hierro
C) Cobre
D) Bronce
E) Plomo
Rpta. : "C"
PROBLEMA 14 :
Un estudiante mezcla dos cantidades de un mismo fluido que están a diferentes temperaturas. La masa y la temperatura en grados Celsius de uno de ellos es el triple de fluido más frío, respectivamente. La temperatura inicial del fluido es 20°C. La temperatura de equilibrio de la mezcla es en (°C).
A) 20
B) 30
C) 40
D) 50
E) 60
Rpta. : "D"
PROBLEMA 15 :
Un calorímetro, cuyo equivalente en agua es, de 50 gramos, contiene 300 gramos de agua a la temperatura de 28°C. Si se introducen 20 gramos de hielo a 0°C. ¿Cuál será aproximadamente la temperatura final de equilibrio?
A) 18°C
B) 22°C
C) 24°C
D) 28°C
E) 30°C
Rpta. : "B"
PROBLEMA 16 :
Una cantidad de 250 gramos de vapor de agua a 100°C se enfría hasta obtener hielo a 0°C. Entonces el calor liberado en todo el proceso es (en kilocalorías); (calor latente de condensación del vapor de agua = 540 cal/g; calor latente de solidificación del hielo = 80 cal/g).
A) 90
B) 120
C) 150
D) 180
E) 210
Rpta. : "D"
PROBLEMA 17 :
Un sólido de 100 g de masa y calor específico 0,2cal/g–°C está a la temperatura de 100°C. Otro sólido también de 100 g de masa y calor específico 0,1 cal/g –°C está a la temperatura de 70°C. Luego, se ponen en contacto ambos cuerpos. Determine la temperatura de equilibrio (°C). Suponga que los calores específicos permanecen constantes.
A) 90
B) 85
C) 80
D) 75
E) 70
Rpta. : "A"
PROBLEMA 18 :
Un bloque de hielo de 1 kg de calor de fusión 80 cal/g, cae desde una altura de 102,5 m, impactando en un lago helado. La masa de hielo fundido por el impacto, será:
A) 0,3kg
B) 3g
C) 0,5 kg
D) 0,25 kg
E) 30 g
Rpta. : "B"
PROBLEMA 19 :
Una bola de plomo (calor específico = 0,03 cal/g°C) de 100 g está a una temperatura de 20°C. se lanza verticalmente hacia arriba con una velocidad inicial de 420 m/s y al regresar al punto de partida choca con un trozo de hielo a 0°C. ¿Cuánto hielo se funde? (Se supone que toda la energía del choque se convierte íntegramente en calor). Equivalente mecánico del calor = 4,2 J/cal Calor de fusión del hielo =80 cal/g
A) 26g
B) 27g
C) 28g
D) 29g
E) 30g
Rpta. : "B"
PROBLEMA 20 :
Una bala moviéndose con una velocidad de 400 m/s choca con una pared y penetra en ella. Suponiendo que el 10% de la energía cinética de la bala se convierta en energía térmica en la bala, calentándola, calcular el incremento de su temperatura.
Calor específico de la bala: C=100 J/kg°C
A) 20°C
B) 40°C
C) 60°C
D) 80°C
E) 100°C
Rpta. : "D"
PROBLEMA 21 :
Una bala de plomo que se desplaza con una rapidez de 400 m/s choca contra una pared consideremos que sólo el 95% de su energía cinética se disipa al medio ambiente. Determinar la variación de temperatura que experimenta la bala si su Ce = 0,03 cal/g°C.
A) 50°C
B) 40°C
C) 35°C
D) 32°C
E) 30°C
Rpta. : "D"
PROBLEMA 22 :
Para calentar 4,5 litros de agua desde 25°C hasta su punto de ebullición, un calentador consume 0,5 kWH de energía eléctrica. El porcentaje de esa energía eléctrica utilizada para calentar el agua es: ... (1 cal = 4,18 J).
A) 22,4
B) 36,8
C) 55,3
D) 60,4
E) 78,3
Rpta. : "E"
PROBLEMA 23 :
Se ha comprobado que, al disminuir la temperatura de control del termostato de una terma de agua durante la noche, hay un ahorro importante de energía. Si el termostato de una terma se ajusta a 28°C durante el día (16 h de promedio) y a 20°C durante la noche (8 h de promedio), estime el porcentaje de ahorro de energía respecto a si se usara el termostato permanentemente a 28°C. Considere que en promedio la temperatura del ambiente es 23°C durante el día y 17°C durante la noche.
A) 30,6
B) 38,1
C) 47,6
D) 65,2
E) 69,2
Rpta. : "B"
PROBLEMA 24 :
Se desea levantar un bloque de 41,8kg hasta una altura de 10m a velocidad constante, para ello se dispone de una máquina que es capaz de convertir 50% del calor que genera en energía mecánica. ¿Cuál es la cantidad de calor que debe generar dicha máquina? (en kcal).
A) 1
B) 2
C) 4,18
D) 10
E) 41,8
Rpta. : "B"