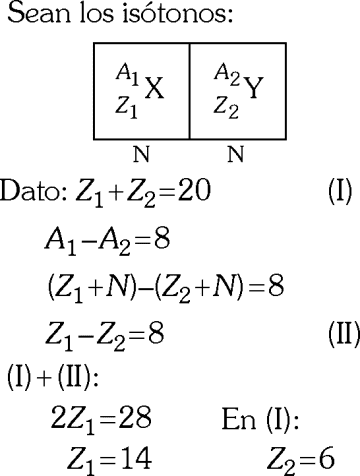QUÍMICA CALLAO PRUEBA RESUELTA UNAC INGRESO UNIVERSIDAD PDF
PREGUNTA 1 :
Entre las siguientes alternativas, escoja la que no representa una mezcla homogénea:
A) Vinagre
B) Aire
C) Acero inoxidable
D) Oro de 18k
E) Sangre
RESOLUCIÓN :
Mezcla homogénea, son aquellas sustancias uniformemente combinadas, sus componentes no se pueden diferenciar incluso al microscopio. Se conocen con el nombre de disoluciones o soluciones y están constituidas por una o varios solutos y un disolvente.
Ejemplo: Vinagre, aire, acero inoxidable, oro de 18 kilates
Rpta. : "E"
PREGUNTA 3 :
Indique verdadero (V) o falso (F), según la clasificación de la materia:
I) El ozono es un compuesto.
II) El amoníaco es una mezcla.
III) El propano es un elemento.
A) VVV
B) VFV
C) FFF
D) FVF
E) FFV
RESOLUCIÓN :
Sustancia simple o sustancia elemental, es aquella formada por átomos o moléculas de un solo elemento químico. Por ejemplo, el oxígeno atómico (O), el oxígeno molecular (O2) y el ozono o Trioxígeno (O3), sus moléculas están solo por átomos de oxígeno.
Compuesto, es una sustancia formada de dos o más elementos de la tabla periódica, son representados por una fórmula química.
I. Ozono (O3) : sustancia
II. Amoniaco (NH3) : compuesto
III. Propano (C3H8) : compuesto
Rpta. : "C"
PREGUNTA 4 :
Si tiene dos isóbaros cuya suma de cargas nucleares es 13 y la diferencia de sus neutrones es la unidad. Determine la cantidad de electrones del anión tetravalente del isóbaro de mayor cantidad de neutrones.
A) 9
B) 8
C) 12
D) 11
E) 10
RESOLUCIÓN :
Para dos isóbaros se cumplen:
– El de mayor cantidad de neutrones, tendrá menor carga nuclear (Z).
– Si la diferencia de sus neutrones es 1, también la diferencia de carga nuclear (Z) es 1.
Sean los isóbaros:
Rpta. : "E"
PREGUNTA 5 :
Un átomo de un elemento “X” posee 18 electrones en orbitales cuya energía relativa es seis. Identifica el periodo y el grupo al cual pertenece el elemento “X”.
A) Periodo: 6; Grupo IIA
B) Periodo: 6; Grupo VA
C) Periodo: 5; Grupo IIA
D) Periodo: 6; Grupo IA
E) Periodo: 5; Grupo VA
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 6 :
Para un átomo que sea ioniza a la forma catión trivalente, sus números cuánticos del último electrón son (3; 2; +2; +1/2).
Halle el número atómico de dicho átomo.
A) 20
B) 25
C) 24
D) 30
E) 26
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 8 :
Un elemento diamagnético se encuentra en el cuarto periodo. ¿Cuál es su número atómico?
A) 30
B) 34
C) 32
D) 18
E) 24
RESOLUCIÓN :
Un elemento diamagnético es repelido débilmente por un imán debido a que posee solo electrones apareados u orbitales llenos.
Por dato, se encuentra en el cuarto periodo (posee 4 niveles); por tanto, su configuración electrónica podría ser:
Rpta. : "A"
PREGUNTA 9 :
El ácido fosfórico es un líquido incoloro y viscoso que se utiliza en detergentes, fertilizante, dentífricos y bebidas gaseosas. Identificar la fórmula del ácido fosfórico:
A) H3PO4
B) HPO3
C) H4P2O7
D) H4P2O5
E) H3PO3
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 10 :
Las sales son sustancias que se usan cotidianamente como el cloruro de sodio (sal de mesa), nitrato de potasio (para dar color a los embutidos y como conservante), el permanganato de potasio (como desinfectante), etc. Estas se obtienen por un efecto de neutralización de los iones para formar la sal y los productos. ¿Cuál de las siguientes sales tiene más átomos de oxígeno por molécula?
A) Sulfito de calcio
B) Perclorato de cobre (II)
C) Permanganato de potasio
D) Hiposulfito de magnesio
E) Hipoyodito de aluminio
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 11 :
Analizando nanoscópicamente la molécula del amoníaco NH3, es notoria la repulsión de los electrones no enlazados alrededor del átomo central.
Esto, hace que el ángulo H–N–H, en el amoníaco sea:
A) igual a 180°
B) mayor que 109,5°
C) menor que 109,5°
D) igual a 109,5°
E) igual a 90°
RESOLUCIÓN :
El nitrógeno en la molécula de amoniaco (NH3) tiene 5e– de valencia y se une con tres átomos de hidrógeno para completar el octeto de electrones, sin embargo, los átomos de hidrógeno son repelidos por los electrones del par solitario de manera que la geometría está distorsionada, formando una pirámide trigonal (pirámide regular de lados) con ángulo de enlace de 107°
Rpta. : "C"
PREGUNTA 12 :
Con respecto a la estructura molecular del ion piro arsénico. Identifica las proposiciones correctas.
I) No tiene ningún enlace dativo.
II) Posee dos enlaces dativos.
III) Posee en total ocho enlaces sigma.
IV) Posee en total cuatro enlaces sigma.
A) I y II
B) II y III
C) II y IV
D) I y IV
E) III y IV
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 13 :
En un recipiente de 1120 mL se tiene almacenado 0,8 gramos de cierto gas, en condiciones normales. ¿Cuál de las siguientes sustancias le corresponde?
Datos: mA (H=1, C=12, O=16)
A) C2H2
B) C2H4
C) CH4
D) C3H6
E) C2H6
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 14 :
Para la recuperación de oro y plata se usa el cianuro de sodio, el cual es altamente contaminante. Para mitigar su impacto de los residuos industriales se usa hipoclorito de sodio de acuerdo a la siguiente reacción:
Calcula la cantidad de kg de NaClO que se requiere para tratar 10 kg de cianuro de sodio.
P.A. (u.m.a): Na=23; Cl =35,5; C=12; O=16; H=1; N=14
A) 35 kg
B) 42 kg
C) 38 kg
D) 40 kg
E) 30 kg
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 16 :
Las sustancias iónicas y las sustancias covalentes con moléculas polares que se disuelven en solventes polares como el agua, conducen la corriente eléctrica.
¿Qué sustancia conduce la electricidad en solución acuosa?
A) SiO2
B) F2
C) H2SO4
D) CCℓ4
E) H2
RESOLUCIÓN :
Analizamos la naturaleza de cada alternativa.
A) SiO2: molécula apolar
B) F2: molécula apolar
C) H2SO4: molécula polar
D) CCℓ4: molécula apolar
E) H2: molécula apolar
Solo el H2SO4 es molécula polar (se disuelve en H2O(ℓ))
Rpta. : "C"
PREGUNTA 18 :
La densidad del agua es 1,0 g/mL a 4°C. Calcular el número de moléculas de agua en 180 mL de agua a dicha temperatura (masa molar del agua es 18 g/ mol; número de Avogadro 6,022×1023)
A) 6,022×1023 moléculas de H2O
B) 6,022×1024 moléculas de H2O
C) 6,022×1025 moléculas de H2O
D) 6,022×1026 moléculas de H2O
E) 6,022×1027 moléculas de H2O
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 19 :
Una mezcla gaseosa constituido inicialmente por 8,0 moles de hidrógeno y 7,2 moles de vapor de yodo, se calienta a 450 °C con lo que se forman en el equilibrio 9,60 moles de HI.
H2(g)+ I2(g)↔ 2HI(g)
La constante de equilibrio Kp es:
A) 5,0
B) 8,4
C) 10,2
D) 12,0
E) 15,7
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 20 :
Se prepara una solución acuosa de hidróxido de estroncio Sr(OH)2 (PM=121), el cual es una base fuerte, para esto se disuelve 2,42 g de hidróxido puro en suficiente agua hasta formar 4 L de solución. Hallar el pOH de dicha solución.
A) 1
B) 2
C) 3
D) 4
E) 5
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 22 :
¿Cuál es la nomenclatura del siguiente compuesto químico?
A) 1-metil-3-cloro-1,3-ciclohexadieno
B) 3-cloro-1-metil-1,3-ciclohexadieno
C) 2-cloro-4-metil-1,3-ciclohexadieno
D) 4-metil-2-cloro-1,3-ciclohexadieno
E) 1-cloro-5-metil-1,5-ciclohexadieno
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 23 :
¿Cuáles de los siguientes compuestos aromáticos tienen igual número de átomos de carbono?
a) metil benceno
b) benceno
c) propilbenceno
d) 1,3-dimetil benceno
e) aminobenceno
A) (b - d)
B) (a - b)
C) (b - e)
D) (a - c)
E) (d - e)
RESOLUCIÓN :
De los compuestos aromáticos, b y e poseen igual número de átomos de carbono.
Rpta. : "C"
PREGUNTA 24 :
Se tiene 36g de hidrocarburo mixto que posee dos enlaces dobles y un enlace triple el cual se quema con suficiente cantidad de oxígeno. Si luego de la reacción se recupera un volumen de agua de 32,4 mL en vaso de precipitación. Determina el número de carbonos del hidrocarburo y el volumen de anhídrido carbónico obtenido a condiciones normales.
A) 9 C y 60,48 L
B) 7 C y 22,4 L
C) 5 C y 44,8 L
D) 8 C y 44,8 L
E) 6 C y 60,48 L
RESOLUCIÓN :
Rpta. : "A"