EXAMEN DE QUIMICA UNI RESUELTO MODELO EXAMEN ADMISION UNIVERSIDAD DE INGENIERIA
PREGUNTA 21 :
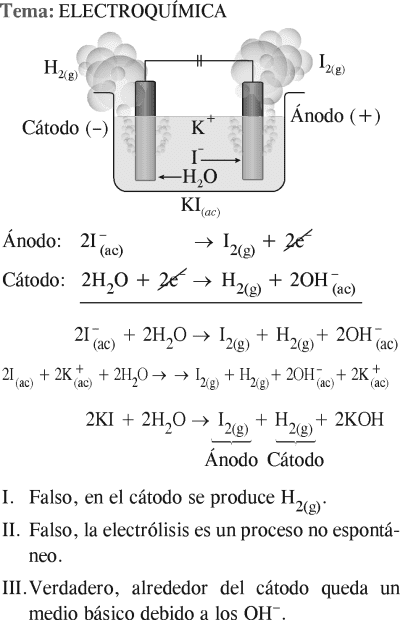
Dadas las siguientes proposiciones con respecto a la electrólisis de una solución de ioduro de potasio (KI), ¿cuáles son correctas?
I. Se produce iodo (I2) en el cátodo.
II. La reacción se lleva a cabo de manera espontánea.
III. La solución que rodea al cátodo cambia a fucsia con la adición de fenolftaleína.
Potencial estándar de reducción (V)
A) solo I
B) solo II
C) solo III
D) I y III
E) I, II y III
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 22 :
La fuerza electromotriz de una celda galvánica es independiente de
A) naturaleza de los electrodos.
B) concentración de los cationes.
C) concentración de los aniones.
D) temperatura del sistema.
E) volumen de los electrolitos.
RESOLUCIÓN :
La diferencia de potencial que se establece entre los dos electrodos de una celda galvánica también recibe el nombre de fuerza electromotriz (fem) de la celda galvánica.
La diferencia de potencial entre los dos electrodos de una pila galvánica o voltaica, recibe el nombre de fuerza electromotriz o potencial estándar de pila, haciendo referencia a la denominación estándar, es decir, [ ]=1 m y T=298K (25°C).
La fem puede verse influenciada por factores como: naturaleza del electrodo, concentración de iones, temperatura entre otros.
Sin embargo, el volumen de los electrolitos no tiene influencia en el cálculo de la fem.
Rpta. : "E"
PREGUNTA 23 :
Se tiene un pequeño volumen de cierta muestra líquida y se determina su densidad mediante un método sencillo. Para esto se midió la masa de un vaso de precipitado vacío y seco obteniéndose 12,074 gramos. Luego se vertió en el vaso 5,6mL de la muestra líquida y la masa medida del vaso y el líquido contenido fue de 17,632 gramos. ¿Cuál es la densidad de la muestra líquida? (kg/m³)
A) 8,83×102
B) 9,93×102
C) 1,04×103
D) 2,09×103
E) 3,06×103
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 24 :
En el horno eléctrico de una siderúrgica se coloca chatarra de acero y después de unos minutos se observa la formación de gases pardo-rojizos los cuales, en corto tiempo, se difunden en el área de trabajo y la zona aledaña. Por otro lado, el acero fundido obtenido en el horno, se vierte en moldes de madera. Pasado un tiempo, a partir del acero fundido se obtienen bolas de acero utilizadas en los molinos. ¿Cuántas de las observaciones subrayadas involucran cambios físicos y químicos, respectivamente?
A) 0, 4
B) 1, 3
C) 2, 2
D) 3, 1
E) 4, 0
RESOLUCIÓN :
Recordemos que la materia se encuentra en permanente cambio. Si el cambio es a nivel físico (la materia mantiene su composición), así como si el cambio es a nivel químico (la materia cambia su composición química). Entonces analizamos las observaciones subrayadas:
• Formación de gases pardo-rojizo: cambio químico
• Se difunden en el área de trabajo: cambio físico
• El acero fundido obtenido en el horno: cambio físico
• A partir del acero fundido se obtienen bolas de acero utilizadas en los molinos: cambio físico
Entonces hay tres cambios físicos y un cambio químico.
MATERIA
I. La formación de gases pardo-rojizos implica la aparición del NO2 que se forma a partir del N2 atmosférico por la alta temperatura en el horno (cambio químico).
II. La difusión del NO2 implica un cambio físico.
III. El acero fundido implica un cambio físico de sólido a líquido.
IV. Del acero fundido se obtiene bolas de acero, implica otro cambio físico de líquido a sólido.
Rpta. : "D"
PREGUNTA 25 :
Señale la alternativa que presenta la secuencia correcta, después de determinar si la proposición es verdadera (V) o falsa (F):
I. El número máximo de orbitales atómicos correspondientes al tercer nivel de energía es nueve.
II. Un orbital atómico tipo p presenta forma tetralobular.
III. El orbital atómico 7pz presenta mayor tamaño que el orbital atómico 6pz
A) VFV
B) VFF
C) FVV
D) VVV
E) FFF
RESOLUCIÓN :
Los números cuánticos, según la resolución de la ecuación de onda de E. Schrödinger, describe las características de los estados de energía: niveles, subniveles y orbitales. Analicemos cada proposición.
I. Verdadera
El número de orbitales como máximo en un nivel n es igual a n².
Si n=3 → 32= 9 orbitales
II. Falsa
El orbital atómico tipo p tiene forma dilobular.
III. Verdadera
El número cuántico principal (n) determina el tamaño o volumen del orbital atómico.
El orbital 7pz (n=7) tiene mayor tamaño que 6pz (n=6).
Rpta. : "A"
PREGUNTA 26 :
El fósforo blanco (P4) es obtenido de acuerdo con las siguientes reacciones:
A) 1,1
B) 2,2
C) 2,6
D) 3,1
E) 3,3
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 27 :
Indique el grupo y periodo de la tabla periódica, respectivamente, correspondiente a un elemento químico cuya configuración electrónica termina en
A) IA ; 4
B) IIIA ; 3
C) VA ; 4
D) VIIIB ; 3
E) IB ; 4
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 28 :
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 29 :
Un recipiente rígido contiene 1000 litros de gas metano (CH4) a 0 °C y una atmósfera. Si se libera el gas hasta que su presión disminuye a la mitad de su valor inicial, manteniendo la misma temperatura, ¿cuántos gramos de metano quedarán en el balón? R=0,082 atm· L/mol K Masas atómicas: H=1, C=12
A) 22,3
B) 44,6
C) 357,2
D) 714,5
E) 1429,4
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 30 :
Una sustancia diamagnética, sin electrones desapareados, es ligeramente repelida por un campo magnético, mientras que una sustancia paramagnética, con electrones desapareados es atraída débilmente por un campo magnético. ¿Cuántas de las siguientes sustancias son paramagnéticas?
A) 1
B) 2
C) 3
D) 4
E) 5
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 31 :
¿Cuáles de las siguientes moléculas presentan momento dipolar nulo?
A) solo I
B) solo II
C) solo III
D II y III
E) I, II y III
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 32 :
Dada la siguiente reacción en medio acuoso
Señale la alternativa que corresponda a un par conjugado ácido-base según Bronsted-Lowry.
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 33 :
La ionización del H₂S en medio acuoso se produce mediante las siguientes reacciones:
¿Cuál es la concentración molar (mol/L) de los iones H+ en una solución acuosa de H2S 0,1 M?
A) 1,0×10–3
B) 1,0×10–4
C) 1,0×10–5
D) 1,0×10–6
E) 1,0×10–7
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 34 :
Dadas las siguientes proposiciones referidas a las siguientes reacciones que ocurren a igual temperatura:
A) solo I
B) solo II
C) solo III
D) I y II
E) I, II y III
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 35 :
En los siguientes oxianiones, indique el que está correctamente nombrado.
RESOLUCIÓN :
De los radicales presentados observamos el bromo que presenta
+1 hipo...oso
+3 ...oso
+5 ...ico
+7 per...ico
Luego, ácido hipobromoso (HBrO), de donde el radical hipobromito será BrO–
Rpta. : "D"
PREGUNTA 36 :
Durante el fenómeno de la disolución pueden desarrollarse una serie de interacciones intermoleculares. ¿Cuáles de las siguientes son posibles?
I. Puente de hidrógeno
II. Ion-dipolo
lll. Dipolo-dipolo inducido
A) solo I
B) solo II
C) solo III
D) I y II
E) I, II y III
RESOLUCIÓN :
Durante el fenómeno de disolución se producen interacciones entre las moléculas y/o iones del soluto y las moléculas del solvente.
• Puente hidrógeno
• Ion - dipolo permanente
• Ion - dipolo inducido
• Dipolo permanente - dipolo permanente
• Dipolo permanente - dipolo inducido
• Dipolo instantáneo - dipolo inducido
Rpta. : "E"
PREGUNTA 37 :
La lejía es una solución utilizada en la desinfección y como sacamanchas. Una lejía tiene una concentración al 5% en masa de hipoclorito de sodio (NaClO). Determine la molaridad (mol/L) de un galón de dicha lejía si tiene una densidad de 1,11 g/mL.
Masa molar (NaClO)= 74,5 g/mol
A) 0,74
B) 1,11
C) 1,48
D) 2,22
E) 2,96
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 38 :
¿Cuál de los siguientes compuestos representa a un aldehído?
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 39 :
Un estudiante analiza los potenciales de reducción del aluminio y hierro:
De su análisis deduce que el aluminio debería corroerse más fácilmente que el hierro y, siendo así, una lata hecha de aluminio con gaseosa debería corroerse más rápidamente. Por lo tanto, las latas de gaseosa deberían hacerse de hierro. Sin embargo, esto no ocurre así. ¿Cuál es la razón por la cual ese proceso de corrosión no se observa en las latas de aluminio?
A) Debido a la capa de óxido de aluminio (Al2O3) que se forma en la superficie del metal y lo protege.
B) El potencial de oxidación del aluminio es muy bajo.
C) El aluminio es pintado con alguna capa de barniz.
D) Se forma carbonato de aluminio insoluble. Al2(CO3)3, sobre el metal y lo protege.
E) El líquido de una gaseosa no es un medio corrosivo.
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 40 :
Los polímeros son grandes moléculas constituidas por una unidad fundamental (monómero) que se repite. Respecto a los tipos de polímeros, y siendo A y B dos monómeros, indique la relación correcta .
I. Homopolímero
II. Copolímero
III. En bloque
a. ~A – B – A – B – A – B ~
b. ~A – A – A – A – A – A ~
c. ~A – A – A – B – B – B ~
A) Ia, IIb, IIIc
B) Ic, IIb, IIIa
C) Ia, IIc, IIIb
D) Ib, IIc, IIIa
E) Ib, IIa, IIIc
RESOLUCIÓN :
POLÍMEROS
Los polímeros son macromoléculas formadas por unión mediante enlaces covalentes de uno o más tipos de unidades simples llamadas monómeros. Pueden clasificarse según su cadena como
Rpta. : "E"