QUÍMICA PREUNIVERSITARIA 2026 LIBRO RESUELTO CON RESPUESTAS DESCARGA PDF
Con la química podemos contestar estas y muchas otras preguntas que nos hacemos siempre que observamos nuestro entorno.
PREGUNTA 1 :
De acuerdo a sus características los contaminantes pueden ser:
I) Tóxico, de vida media corta.
II) Tóxico, de vida media larga.
III) Muy baja toxicidad y vida media larga.
IV) Inocuo y vida media muy larga.
V) Radioactivo y de vida media efímera.
¿Cuál de ellos considera usted el de mayor peligro para la población?
A) III
B) IV
C) V
D) I
E) II
RESOLUCIÓN :
CONTAMINACIÓN AMBIENTAL
Las sustancias tóxicas es toda sustancia química que puede causar efectos perjudiciales sobre el ser vivo y el medio que lo rodea, esto empeora cuando el tiempo de vida es larga ya que afecta una mayor cantidad de individuos.
Rpta. : "E"
PREGUNTA 2 :
De la experiencia de Rutherford se dedujo lo siguiente:
A) La mayor parte del átomo es espacio vacío, el núcleo debía ser muy pequeño y de carga positiva, alrededor del núcleo giran los electrones.
B) La mayor parte del átomo concentra a los electrones, el núcleo puede ser excéntrico y contiene neutrones, los electrones forman una nube.
C) Los átomos parecen un budín de pasas, con núcleo central y una nube conteniendo los electrones.
D) Los átomos tienen un núcleo central, los electrones giran alrededor de él y al ganar energía pueden pasar de un nivel a otro.
E) Los átomos son esferas compactas de diverso tamaño según el elemento, indivisibles y con una nube electrónica.
RESOLUCIÓN :
En 1909 Rutherford dirigió un experimento conocido como “Experimento de la laminilla de oro” en que dedujo que: La mayor parte del átomo es espacio vacío, el núcleo debía ser muy pequeño y de carga positiva, alrededor del núcleo giran los electrones.
Rpta. : "A"
PREGUNTA 3 :
Si 990 gramos de trióxido de diarsénico reacciona con hidrógeno produciendo 216 gramos de agua.
As2O3 + H2 → AsH2 + H2O
¿Cuál es el rendimiento de la reacción?
masas atómicas (H=1, O=16, As=75)
A) 50%
B) 60%
C) 70%
D) 80%
E) 90%
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 4 :
Se coloca una olla vacía sobre una hornilla encendida. Si la temperatura inicial fue de 17°C y la final de 307°C, ¿qué porcentaje de masa de aire, fue expulsado de la olla, al terminar el calentamiento?
A) 40%
B) 30%
C) 50%
D) 70%
E) 60%
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 5 :
En un recipiente herméticamente cerrado se tiene 10 g de H2, 48 g de CH4 y 64 g de O2. Si esta mezcla de gases ejerce una presión total de 5 atmósferas.
¿Cuál será la presión parcial del oxígeno?
Masa atómicas: H=1, C=12, O=16
A) 1,5 atm
B) 2,0 atm
C) 1,0 atm
D) 3,0 atm
E) 2,5 atm
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 6 :
En un recipiente hermético de 2 litros de capacidad se tiene en equilibrio químico 0,8 mol de fosgeno (COCℓ2), 0,6 mol de monóxido de carbono (CO) y 0,4 mol de cloro (Cℓ2).
Determine la constante Kc.
COCℓ2(g) ⇄ CO + Cℓ2(g)
A) 0,20
B) 0,25
C) 0,10
D) 0,15
E) 0,05
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 8 :
De acuerdo a la teoría de Brönsted-Lowry
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 9 :
Un profesor sentenció en clase:
"El agua por ser solvente polar, no disuelve al oxígeno que es apolar". Un alumno le pregunta, ¿y cómo respiran los peces?
¿Qué teoría explica la presencia de oxígeno en el agua?
A) El enlace puente de hidrógeno
B) El enlace dipolo-dipolo
C) El enlace coordinado
D) Las fuerzas de London
E) El enlace iónico
RESOLUCIÓN :
FUERZAS INTERMOLECULARES
Las fuerzas de London permite que una molécula apolar como el oxígeno
tenga movimiento de electrones, formando un dipolo instantáneo que sufre atracción por un dipolo permanente como es la molécula de agua H2O y permite la disolución del O2 en el H2O.
Rpta. : "D"
PREGUNTA 10 :
El agua es un disolvente por excelencia porque iones y moléculas se disuelven en ella por ser una molécula polar.
De allí se dice “Que lo semejante disuelve a lo semejante”.
Identifique la fórmula que NO se disuelve en el agua.
A) SiO2
B) NaHCO3
C) C12H22O11
D) CuSO4·5H2O
E) Ba(OH)2
RESOLUCIÓN :
POLARIDAD DE MOLÉCULAS
Pide identificar la fórmula de la sustancia que no se disuelve en agua. El agua (H2O) es un disolvente polar y disuelve en general compuestos iónicos y moléculas de naturaleza polar (lo semejante disuelve a lo semejante)
Rpta. : "A"
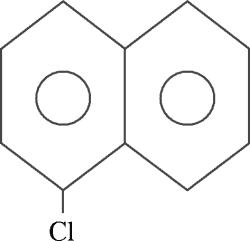
PREGUNTA 11 :
Nombre el siguiente compuesto orgánico:
A) 3-cloro naftaleno
B) 5-cloro naftaleno
C) 2-cloro fenantreno
D) 2-cloro fenilbenceno
E) 1-cloro antraceno
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 12 :
Durante un proceso productivo, el equivalente de gases de efecto invernadero (GEI) emitidos según la huella de carbono, es de 100 T/días con el fin de disminuir esta huella, un equipo de especialistas presentan un prototipo que emitiría solo 80 T/día de metano (CH4) en torno a ello colocar "V" o "F" según el valor de verdad.
( ) No sería viable porque la huella de C aumentaría en 680 T/día.
( ) El metano tiene menor capacidad de retención energética que el CO2.
( ) Es sustentable emitir 80 T de CH4 en lugar de 1000T de CO2/por día.
A) VFF
B) FVF
C) VVF
D) FVV
E) VFV
RESOLUCIÓN :
CONTAMINACIÓN AMBIENTAL
La huella de carbono se mide en masa de CO2 equivalente (CO2e o CO2eq). Se usa así porque el CO2 es el gas más abundante entre los GEI y se utiliza como referencia en la medición del resto de los elementos.
La importancia de conocer la huella de carbono radica en la posibilidad de saber con más certeza la manera en que los GEI contribuyen al calentamiento global y aceleran el cambio climático.
A la hora de calcular la huella de carbono, utilizamos el CO2 equivalente (t CO2eq), una unidad de medida en toneladas que calcula la emisión de todos los gases que mencionamos anteriormente. ¿Cómo? La masa de los gases emitidos se mide por su equivalencia en CO2 para generar efecto invernadero. Por ejemplo, esa equivalencia nos dice que 1 tonelada de Metano (CH4) produce tanto efecto invernadero en la atmósfera como 25 toneladas de CO2.
Rpta. : "A"
SEGUNDA PRUEBA
PREGUNTA 1 :
A) 35Cℓ17
B) 36S16
C) 40Ar18
D) 40Cℓ17
E) 35S16
RESOLUCIÓN :
PREGUNTA 2 :
Calcule la densidad del oxigeno en g/L a 47°C y 2,2 atm de presión.
Datos
PV =nRT
R=0,082L⋅atm/mol⋅k= 8,314Joule/mol⋅k
A) 2,93
B) 3,10
C) 2,10
D) 3,68
E) 2,68
RESOLUCIÓN :
PREGUNTA 3 :
¿Cuál es el óxido ácido para formar el producto del H2SO3?
A) SO4
B) SO3
C) SO2
D) S2O
E) H2S
RESOLUCIÓN :
PREGUNTA 4 :
La fórmula del hidruro de litio es:
A) LiH2
B) Li(OH)2
C) Li2H
D) LiOH
E) LiH
RESOLUCIÓN :
Los hidruros son compuestos binarios formados por átomos de hidrógeno y de otro elemento que puede ser metálico o no metálico.
PREGUNTA 6 :
Se mezcla 250 mL de una solución acuosa 0,2 M de ácido nítrico, HNO3, con 150 mL de una solución acuosa 0,3 M de amoniaco, NH3, como producto de la reacción se obtiene la sal conocida como nitrato de amonio, NH4NO3. Determine la concentración de la sal formada al final de la reacción.
A) 0,1025 M
B) 0,2375 M
C) 0,1250 M
D) 0,1125 M
E) 0,2500 M
RESOLUCIÓN :
PREGUNTA 7 :
Identifique el compuesto que no es ácido carboxílico.
A) Ácido palmítico
B) Ácido acético
C) Ácido benzoico
D) Ácido muriático
E) Ácido fórmico
RESOLUCIÓN :
PREGUNTA 8 :
Determine la cantidad de equivalentes gramo que hay en 260 g de ácido sulfúrico, H2SO4. Datos:
H: 1 uma
S : 32 uma
O : 16 uma
A) 3,18
B) 2,65
C) 5,31
D) 7,96
E) 10,61
RESOLUCIÓN :
PREGUNTA 9 :
En la figura se muestra soluciones acuosas y agua destilada. Indique verdadero (V) o falso (F) respecto a los siguientes enunciados:
a. La concentración de (I) es de 0,2 M
b. Si se mezcla I y III la concentración resultante es de 0,1 M
c. Para neutralizar II se necesita 30 mL de la Solución (I)
Datos:
Na: 23 uma ; O:16 uma ; H: 1 uma
A) VVV
B) VVF
C) FVV
D) FFF
E) VFV
RESOLUCIÓN :
PREGUNTA 10 :
En las siguientes reacciones reversibles
A) Solo II
B) I y III
C) I, II y III
D) II y III
E) I y II
RESOLUCIÓN :
PREGUNTA 12 :
La radioactividad está asociada con la ruptura espontánea del átomo, con emisión de partículas y/o radiación. Con respecto a las velocidades de las radiaciones α, β, γ; en las alternativas, identifica la relación correcta:
A) α >β >γ
B) α <β<γ
C) α =β >γ
D) α > γ > β
E) α =β = γ
RESOLUCIÓN :
La radioactividad está asociada con la ruptura espontánea del núcleo atómico con emisión de partículas (α, β) y/o radiación (γ).
Por lo tanto, el orden de velocidad es α < β <γ
Rpta. : "B"
PREGUNTA 13 :
Una forma de purificar el CO2 exhalado por los astronautas en la cabina de las estaciones espaciales, se realiza mediante la reacción: Con respecto a las sustancias presentes en la reacción, selecciona la secuencia correcta de verdadero (V) o falso (F) de las siguientes proposiciones:
I. El CO2 es un anhidrido y su nombre común es dióxido de carbono.
II. El NaOH es un hidruro metálico y su nombre es hidruro de sodio.
III. El nombre de la sal oxisal es carbonato de sodio.
A) VVF
B) VFV
C) VVV
D) FFV
E) FVV
RESOLUCIÓN :
NOMENCLATURA INORGÁNICA
CO2+NaOH → Na2CO3+H2O
I. FALSO
El nombre común o tradicional del CO2 es anhídrido carbónico.
II. FALSO
El NaOH es un hidróxido y su nombre es hidróxido de sodio.
III. VERDADERO
Na2CO3 es una sal oxisal y su nombre es carbonato de sodio.
Rpta. : "D"
PREGUNTA 14 : Se tiene un pistón vertical, que encierra aire, cerrado en su parte superior por una tapa cuando se encuentra a una altura de 12 cm. Calcula el desplazamiento de la tapa si la presión disminuye en 20% manteniendo constante su temperatura.
a) Baja 4 cm
b) Sube 4 cm
c) Sube 3 cm
d) Baja 2 cm
e) Baja 3 cm
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 15 :
El alcohol yodado mancha la ropa en el l₂(s) cuando está disuelto en Kl alcohólico, esta se puede limpiar sin usar detergente con una solución de sulfitos (SO3)–2 que lo reduce a ion I− en medio básico, según la ecuación:
I2 + [SO3]2– → [SO4]2– + I–
Calcula el número de electrones por cada 10 moles de I₂ reducido.
a) 5
b) 10
c) 20
d) 12
e) 30
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 16 :
Las soluciones de nitrato de calcio Ca (NO3)2, ácido sulfúrico H2SO4 e hidróxido de calcio Ca (OH)₂ tienen muchos usos industriales. Determina el peso equivalente de cada compuesto en cada solución, respectivamente.
Dato de Masa molar: Ca (NO3)2=164; H2SO4=98; Ca (OH)2=74
a) 64–98–74
b) 82–49–25
c) 82–49–37
d) 49–25–37
e) 30–49–82
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 17 : Los compuestos orgánicos presentan varios tipos de fórmulas: desarrolladas, semidesarrolladas y globales. Lo más común es representar un compuesto orgánico mediante una fórmula semidesarrollada como la que se muestra:
Al respecto, selecciona el valor de verdad (V) o falsedad (F) de las proposiciones.
I. La cadena presenta seis enlaces sigma C – C.
II. Existen tres enlaces pi en el compuesto orgánico.
III. La fórmula global del compuesto es: C6H9N.
A) VFV
B) VVV
C) FVV
D) FFF
E) FFV
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 18 :
El enunciado:
“Para una misma masa de un gas a una temperatura dada, siempre en producto de la presión por su volumen respectivo es constante”.
Corresponde a la:
A) Ley de las Isóbaras
B) Ley de las Isócoras
C) Ley de las Isotermas
D) Ley de Avogadro
E) Ley de Dalton
RESOLUCIÓN :
LEY DE LAS ISÓBARAS
«Si la presión de una masa gaseosa permanece constante. Los volúmenes y las temperaturas absolutas son proporcionales».
Se le llama proceso isobárico, también se le conoce tradicionalmente como la ley de las isóbaras o ley de Charles.
V1/T1= V2/T2
B) Falsa
LEY DE LAS ISÓCORAS
En un proceso donde se mantiene constante el volumen de una masa gaseosa, la presión varía directamente con la temperatura absoluta.
Se le llama proceso isométrico tradicionalmente ley de Gay Lussac o ley de las isócaras.
P1/T1= P2/T2
C) Verdadera
LEY DE LAS ISOTERMAS
«Si la temperatura de una masa gaseosa permanece constante, las presiones son inversamente proporcionales a los volúmenes ocupados por el gas».
Se le llama proceso isotérmico tradicionalmente ley de las isotermas o ley Robert Boyle y Edmond Mariotte.
D) Falsa
LEY DE AVOGADRO
Establece la relación entre la cantidad de gas y su volumen cuando se mantienen constantes la temperatura y la presión.
V1/n1= V2/n2
E) Falsa
LEY DE DALTON
«Cuando se unen dos sustancias para formar otra diferente, donde el peso o masa de una de ellas permanece constante el peso total de la otra varia en números enteros y sencillos».
Rpta. : "C"
PREGUNTA 19 :
Se tiene tres isotopos cuyos números de masa son números consecutivos, si el promedio aritmético de sus números de masa es 16 y el isotopo más liviano posee siete neutrones, ¿Cuál será la suma de los neutrones de los otros dos?
A) 16
B) 17
C) 20
D) 15
E) 18
RESOLUCIÓN :
ISÓTOPOS O HÍLIDOS
Son átomos de un mismo elemento que tienen igual número atómico diferente número de masa y diferente número de neutrones.
Propiedades a
. Ocupan un mismo lugar en la tabla periódica debido a que tiene igual número atómico.
b. Tienen diferente número de neutrones.
c. Tienen la misma distribución electrónica, debido a que tienen igual número de electrones.
d. Tienen propiedades químicas similares, debido a que tienen igual número de electrones de valencia .
Rpta. : "B"
PREGUNTA 20 :
Un gas se encuentra a ciertas condiciones iniciales. Si se aumenta su temperatura, se cumple que:
A) La presión disminuye
B) La densidad aumenta
C) El volumen disminuye
D) La presión es constante
E) La densidad disminuye
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 22 :
Para la formación de un mol de O2 la energía de enlace necesaria es de 1,20×10⁵ cal. Determinar la energía necesaria para formar una molécula de O2
A) 2,01×10−¹⁵ cal
B) 1,90×10¹⁹ cal
C) 1,99×10−¹⁵ cal
D) 1,99×10−¹⁹ cal
E) 2,01×10¹⁹ cal
RESOLUCIÓN :
MOLÉCULA GRAMO, MOL GRAMO O MOL
Concepto tradicional
Es el peso molecular expresado en gramos:
Mol = (M) g
Concepto actual
Es el número de Avogadro en moléculas expresado en gramos.
Mol = (N₀. Moléculas ) g
1 mol de O₂ contiene 6,022×10²³ moléculas
6,022×10²³ moléculas ––––– 1,20×10⁵ cal.
1 molécula ––––– x
⇒ x = 1,99×10−¹⁹ cal
Rpta. : "D"
PREGUNTA 23 :
¿Qué volumen de disolvente debe agregarse a 5 cm³ de disolución de HC1 6 M para obtener una disolución de HC1 0,1 M?
A) 285 cm³
B) 275 cm³
C) 295 cm³
D) 266 cm³
E) 235 cm³
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 24 :
La combustión completa del propano, da como producto: dióxido carbono y agua. ¿Cuántos gramos de propano reaccionan con 10 g de oxígeno?
A) 1,00 g
B) 4,40 g
C) 2,75 g
D) 3,20 g
E) 5,00 g
RESOLUCIÓN :
LEY DE LOUIS JOSEPH PROUST O LEY DE LAS PROPORCIONES DEFINIDAS, CONSTANTES
Cuando dos sustancias reaccionan para formar un nuevo producto, la relación de sus pesos o masas, siempre están en una relación fija, constante o definida.
Rpta. : "C"
PREGUNTA 25 :
Un recipiente cerrado contiene 64 g de O2 y 224 g de N2 que ejercen una presión total de 800 mm Hg. Calcular la presión parcial del O2.
A) 60,0 mm Hg
B) 64,0 mm Hg
C) 160,0 mm Hg
D) 120,0 mm Hg
E) 100,0 mm Hg
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 26 :
En el compuesto Fe2(Cr2O7)3 el Cr actúa con número de oxidación:
A) 2⁺
B) 3⁺
C) 6⁺
D) 4⁺
E) 2⁻
RESOLUCIÓN :
NÚMERO O ESTADO DE OXIDACIÓN
Es la carga eléctrica hipotética que el átomo tendría si todos sus enlaces con elementos distintos fueran 100 % iónicos.
En los compuestos iónicos es real, y en los compuestos moleculares es carga aparente.
El compuesto es neutro, la suma de las cargas positivas y negativas aportadas por cada elemento debe ser cero
2(+3) + 3.2.x + 3×7×(–2) = 0
⇒x = 6+
Rpta. : "C"
PREGUNTA 27 :
Un balón de 50 L de capacidad contiene O₂ a la temperatura de 27 °C y 2 atm de presión. Calcular la masa de O2 en el balón.
A) 130,0 g
B) 13,0 g
C) 150,0 g
D) 15,0 g
E) 100,0 g
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 28 :
Se llama carbono primario al que se encuentra unido a:
A) Dos átomos de carbono
B) Un átomo de carbono
C) Un átomo de hidrógeno
D) Tres átomos de carbono
E) Dos átomos de hidrógeno
RESOLUCIÓN :
TIPOS DE CARBONO
Carbono primario, átomo que está unido a un sólo átomo de carbono mediante un enlace simple, los átomos de hidrógeno unidos a este tipo de carbono se denominan primarios.
Cada átomo de carbono primario tiene tres hidrógenos primarios.
Rpta. : "B"
PREGUNTA 29 :
En la siguiente reacción:
El producto pie se obtiene es el:
A) 2-clorobutano
B) 2-cloro-2-mctilpropano
C) 1 cloro-2-metilpropano
D) Cloruro de isopropilo
E) Cloruro de secpropilo
RESOLUCIÓN :
Alquenos
Reacción de adición de halogenuros de hidrógeno
Cuando se hacen reaccionar los halogenuros de yodo, cloro y bromo en estado gaseoso, con un alqueno en un disolvente inerte, como el tetracloruro de carbono, se producen los halogenuros de alquilo, a través de la reacción de hidrohalogenación. El orden de actividad en esta reacción a los halógenos, es así:
HI > HBr > HCl.
Es posible obtener uno de estos isómeros o ambos. Hacia el año de 1869 Markownikoff con base en estas observaciones, enunció una regla que hoy lleva su nombre y que establece: el átomo de hidrógeno (parte positiva) se adiciona al carbono que tenga el mayor número de átomos de hidrógeno, y el anión del ácido (parte negativa) se adiciona al carbono que tenga el menor número de átomos de hidrógeno.
Rpta. : "B"
PREGUNTA 30 :
La reacción química entre una grasa y un hidróxido de sodio se llama reacción de
A) Esterificación
B) Eterificación
C) condensación
D) saponificación
E) sublimación
RESOLUCIÓN :
SAPONIFICACIÓN
Es la reacción de una grasa neutra (sólida, cebo, manteca o líquida) con una base, originando jabón y 1,2,3 propanotriol (glicerol o glicerina).
Esta importante reacción descompone las sustancias grasas cuando se las hierve con una solución de un hidróxido fuerte, como el de sodio o el de potasio (concentración de entre el 22 % y el 24 %).
Estas sales son los jabones.
Las reacciones de saponificación no son reversibles. La palabra saponificar significa producir jabón. Molecularmente es una hidrólisis de los triésteres (grasas neutras) por medio de un álcali fuerte (hidróxido de sodio o de potasio).
A) Incorrecta
La esterificación es una reacción en la cual al menos uno de los productos es un éster, teniendo como catalizador hidrógeno protónico o hidrogenion.
La esterificación de Fischer-Speier o esterificación de Fischer es un tipo especial de esterificación que consiste en la formación de un éster por reflujo de un ácido carboxílico y un alcohol, en presencia de un catalizador ácido.
B) Incorrecta
La eterificación es la formación de éteres y se realiza por síntesis de Williamson; al combinarse alcóxido y halogenuro de alquilo.
C) Incorrecta
En química orgánica, se conoce como reacciones de condensación a aquellas que se llevan a cabo entre dos compuestos, los cuales tienen el grupo funcional carbonilo dentro de su estructura ( C=O).
D) correcta
E) Incorrecta
SUBLIMACIÓN Es el paso de un sólido a un gas sin pasar por el estado intermedio líquido, manteniendo la temperatura constante, la sublimación es de dos tipos:
a. Sublimación progresiva
Llamada también sublimación directa, simple, volatilización o Sublimación por ejemplo: el alcanfor, el yodo, el arsénico blanco, el azufre, el fósforo rojo, naftaleno o naftalina, el hielo seco.
b. Sublimación regresiva
Llamada también sublimación indirecta o inversa y en forma incorrecta
deposición o depositación por ejemplo: yodo gaseoso a yodo sólido, formación de la nieve.
Rpta. : "D"





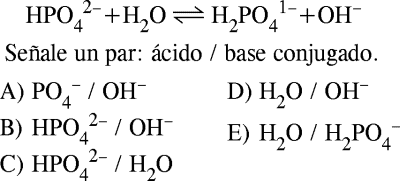







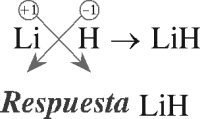








.png)
.png)
.png)
.png)
.png)
.png)



















































