QUÍMICA VILLARREAL PRUEBA RESUELTA UNFV INGRESO UNIVERSIDAD PDF
PREGUNTA 1 :
Indique verdadero (V) o falso (F), según corresponda.
( ) Todo elemento se identifica con un número de protones.
( ) Todos los isótopos del hidrógeno tienen protones.
( ) Los isótopos tienen igual número de neutrones.
A) VVV
B) VVF
C) VFF
D) FVF
E) VFV
RESOLUCIÓN :
(V) Todo elemento se identifica con un número de protones.
(V) Todos los isótopos del hidrógeno tienen protones.
(F) Los isótopos tienen igual número de neutrones.
Rpta. : "B"
PREGUNTA 2 :
Si ocurre una reacción química en forma natural o artificial, se evidencia cambios tales como:
A) cambio de color, olor y sabor
B) liberación o absorción de energía calorífica
C) desprendimiento de un gas
D) formación de precipitados
E) constituye una mezcla
RESOLUCIÓN :
Las evidencias de una reacción química son 5:
1. Cambio de color
2. Liberación de calor
3. Formación de un sólido (precipitado)
4. Liberación de luz y
5. Liberación de un gas (burbuja)
Rpta. : "C"
PREGUNTA 3 :
Si el número de masa de un átomo es el triple de diez más uno y en su tercer nivel de energía presenta 5 electrones, ¿cuántos neutrones presentará el átomo?
A) 16
B) 31
C) 15
D) 5
E) 14
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 4 :
Las propiedades intensivas de la materia
A) viscosidad, presión
B) viscosidad, peso especifico
C) temperatura de ebullición, calor transferido
D) olor, inercia
E) impenetrabilidad, masa
RESOLUCIÓN :
La propiedad intensiva de la materia no depende de la cantidad de sustancia estas son:
✓ Densidad
✓ Color
✓ Olor
✓ Sabor
✓ Punto de ebullición
✓ Conductibilidad eléctrica
✓ Calor especifico
✓ Viscosidad
✓ Electronegatividad.
Rpta. : "C"
PREGUNTA 5 :
La atmósfera de Marte está formada principalmente por dióxido de carbono (CO2). Si una muestra de 17,6 g de este gas es atrapada por el Mars Exploration Rover en un recipiente de 8,2 L a 7°C, calcule la presión en atm que ejerce dicho gas en el recipiente.
Datos:
R=0,082 atm·L/mol–1·K–1
Masa molar (g/mol): CO2=44
A) 13,56
B) 49,28
C) 2,24
D) 1,12
E) 1,23
RESOLUCIÓN :
ESTADO GASEOSO
Rpta. : "D"
PREGUNTA 6 :
Seleccione la relación correcta entre ion - número total de electrones.
A) 16S2– ––– 14
B) 55Cs+ ––– 55
C) 15P3– ––– 18
D) 31Ga3+ ––– 34
E) 12Mg2+ ––– 12
RESOLUCIÓN :
Rpta. : "C"
PREGUNTA 7 :
Señale la expresión incorrecta
A) 4s
B) 5p
C) 3d
D) 3f
E) 5s
RESOLUCIÓN :
En el nivel 3 solo hay tres subniveles que son el subnivel s, el subnivel p y el subnivel d.
Rpta. : "D"
PREGUNTA 9 :
De la experiencia de Rutherford se dedujo lo siguiente:
A) La mayor parte del átomo es espacio vacío, el núcleo debía ser muy pequeño y de carga positiva, alrededor del núcleo giran los electrones.
B) La mayor parte del átomo concentra a los electrones, el núcleo puede ser excéntrico y contiene neutrones, los electrones forman una nube.
C) Los átomos parecen un budín de pasas, con núcleo central y una nube conteniendo los electrones.
D) Los átomos tienen un núcleo central, los electrones giran alrededor de él y al ganar energía pueden pasar de un nivel a otro.
E) Los átomos son esferas compactas de diverso tamaño según el elemento, indivisibles y con una nube electrónica.
RESOLUCIÓN :
En 1909 Rutherford dirigió un experimento conocido como “Experimento de la laminilla de oro” en que dedujo que: La mayor parte del átomo es espacio vacío, el núcleo debía ser muy pequeño y de carga positiva, alrededor del núcleo giran los electrones.
Rpta. : "A"
PREGUNTA 10 :
A qué familia de la tabla periódica pertenece el siguiente elemento 3517X
A) alcalinos
B) halógenos
C) térreos
D) anfígenos
E) gases nobles
RESOLUCIÓN :
17=z
Se realiza la distribución electrónica de 17 electrones 1s22s22p63s23p5
Pertenece al grupo VIIA → halógenos
Rpta. : "B"
PREGUNTA 12 :
Con respecto a la tabla periódica, ¿cuál de los siguientes elementos no pertenece a la familia de los elementos indicados?
A) Sodio (Na) metal alcalino
B) Estroncio (Sr) metal alcalino térreo
C) Xenón (Xe) gas noble.
D) Bario (Ba) metal alcalino térreo.
E) Iridio (Ir) gas noble.
RESOLUCIÓN :
Los gases nobles (VIIIA) están conformados por los elementos He, Ne, Ar, Kr, Xe, Rn; luego la clave incorrecta sería que el Iridio sea gas noble, pues se trata de un elemento de transición con Z=57.
Rpta. : "D"
PREGUNTA 13 :
Determine el número de oxígeno que contiene el permanganato de calcio:
A) 4
B) 2
C) 3
D) 8
E) 6
RESOLUCIÓN :
El permanganato de calcio tiene como fórmula: Ca(MnO4)2 De esta fórmula nos percatamos que dicha sustancia posee 8 oxígenos.
Rpta. : "D"
PREGUNTA 14 :
Identifique la acción en la que se producen cambios químicos:
I) doblar un alambre por calentamiento
II) descomponer el agua por acción de la corriente eléctrica
III) hervir agua mediante paneles solares
IV) hacer que se oxide un clavo de hierro
A) I solamente
B) I y II
C) III solamente
D) II y IV
E) IV solamente
RESOLUCIÓN :
II y IV son acciones que producen cambios químicos, quiere decir que al producirse varía su estructura química, produciéndose nuevas sustancias.
En cambio I y III la sustancia solo sufre cambio físico sin comprometer su estructura química.
Rpta. : "D"
PREGUNTA 15 :
El magnesio, en su forma iónica, es el segundo catión celular más abundante después del potasio. Con respecto al elemento magnesio (12Mg), señale la secuencia correcta después de determinar si la proposición es verdadera (V) o falsa (F).
I) Su configuración electrónica abreviada es [Ne]3s2.
II) Su configuración electrónica presenta a todos sus electrones apareados.
III) Es una especie química que presenta paramagnetismo.
A) FFF
B) VVV
C) VVF
D) VFV
E) FVV
RESOLUCIÓN :
CONFIGURACIÓN ELECTRÓNICA
Rpta. : "C"
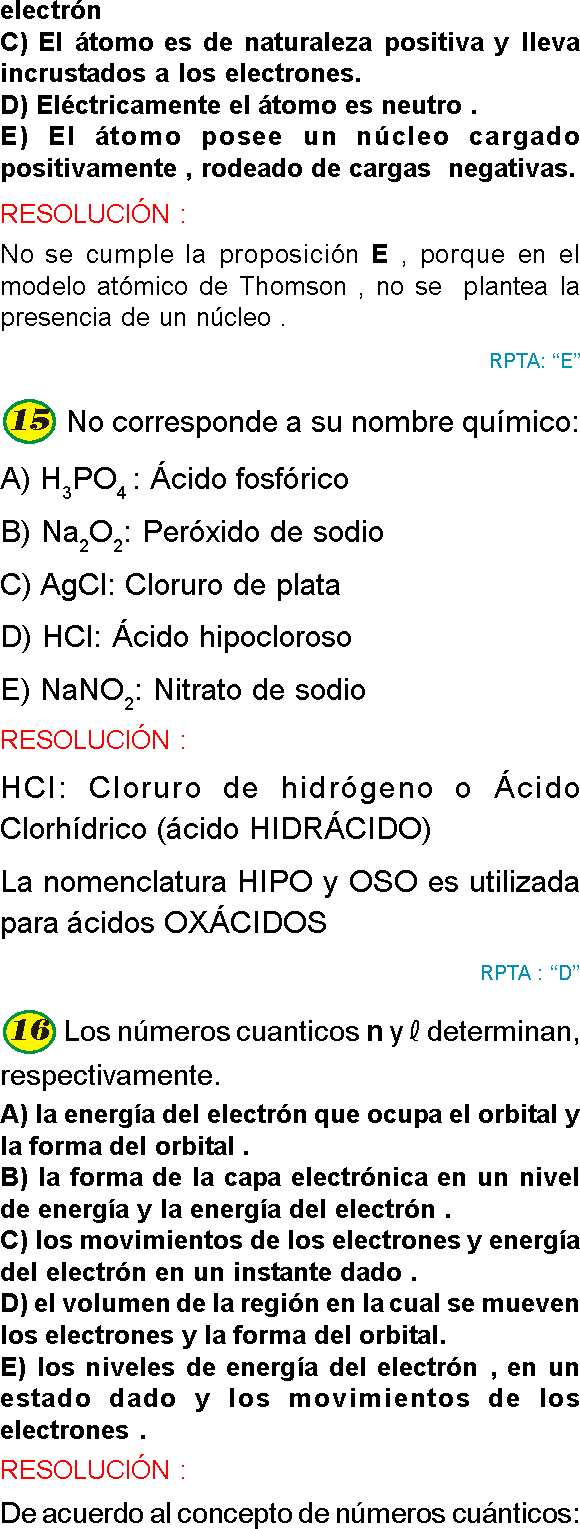
PREGUNTA 16 :
Ernest Rutherford describe el átomo como si fuera
A) una esfera compacta.
B) un budín de pasas.
C) un sistema solar.
D) un sistema esférico con niveles estacionario.
E) una nube esférica.
RESOLUCIÓN :
Ernest Rutherford consideró que el átomo en su mayor parte presenta espacio vacío, presenta un núcleo central alrededor del cual gira los electrones de carga negativa comparándolo a un sistema solar.
En cambio las respuestas:
a. Pertenece a J.Dalton
b. Pertenece a J. Thomson
d. Pertenece a Niels Bohr
e. Pertenece a Schrödinger.
Rpta. : "C"
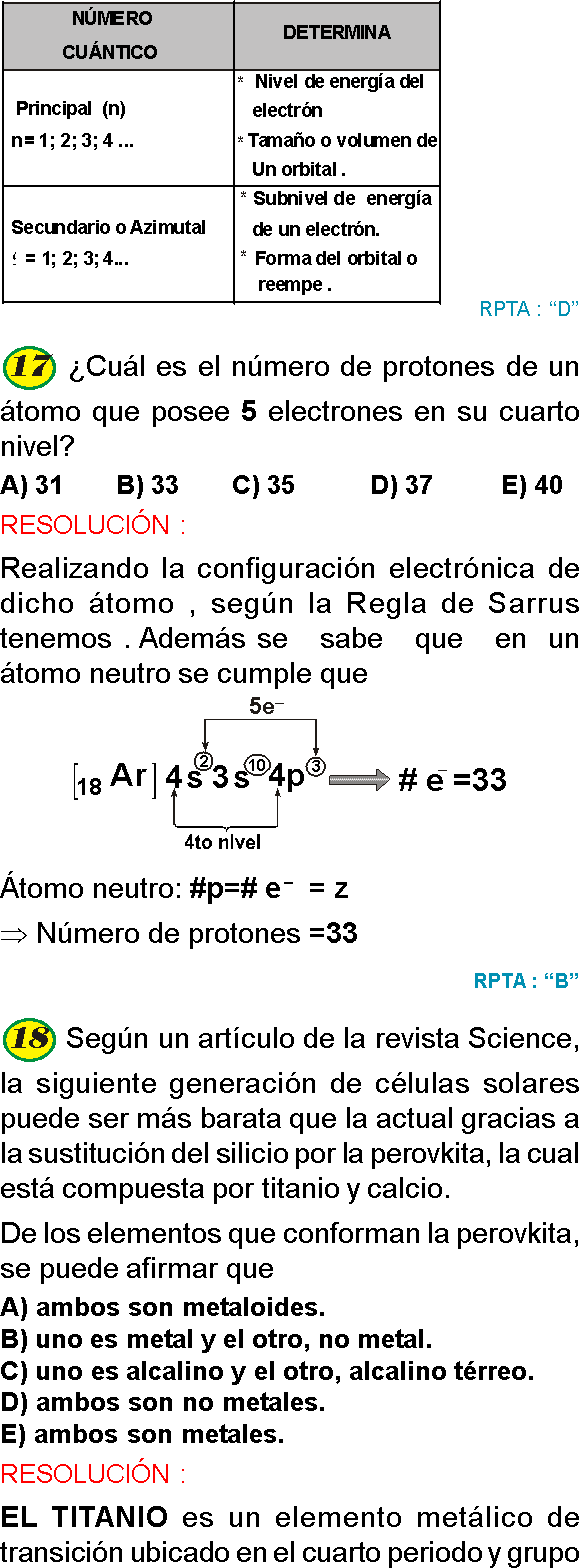
PREGUNTA 17 :
Uno de los siguientes compuestos no presenta enlace iónico. ¿Cuál es?
A) CaO
B) CO2
C) NaCl
D) K2O
E) A y C
RESOLUCIÓN :
Un enlace iónico generalmente se da entre un metal y no metal, dentro de las alternativas se observa que el CO2 esta formado por no metales que forma un enlace llamado covalente
Rpta. : "E"
PREGUNTA 18 :
El anión E3– tiene 54 electrones y 71 partículas neutras, indique el número de masa del átomo “E”.
A) 122
B) 120
C) 115
D) 114
E) 113
Rpta. : "A"
PREGUNTA 19 :
Complete correctamente:
" el ______ de un elemento es su peso atómico expresado en gramos".
A) átomo gramo
B) peso atómico
C) peso molecular
D) núcleo
E) átomo neutro
Rpta. : "A"
PREGUNTA 20 :
Es el peso promedio relativo y ponderado de las moléculas de una sustancia, siempre comparado, con el (UMA).
A) Átomo gramo
B) Peso nuclear
C) Peso molecular
D) Mol gramo
E) Masa molar
Rpta. : "C"
PREGUNTA 21 :
En determinadas condiciones, el elemento X (Z=12) se combina con el elemento Y (Z=9). Indique, respectivamente, el tipo de enlace que se establece entre dichos elementos y la fórmula del compuesto.
A) iónico; X2Y
B) iónico; XY3
C) covalente; XY2
D) covalente; XY
E) iónico; XY2
Rpta. : "E"
PREGUNTA 22 :
¿Qué compuesto está mal nombrado?
A) CaO: óxido de calcio
B) PbO2: dióxido de plomo
C) HCl: cloruro de hidrógeno
D) H2SO3: ácido sulfúrico
E) Cu(OH)2: hidróxido de cobre (II)
Rpta. : "D"
PREGUNTA 23 :
Al combustionar 8 gramos de metanol CH3OH se obtuvo 8,1 gramos de agua. ¿Cuál fue el porcentaje de rendimiento de dicho proceso?
CH3OH + O2→ CO2+ H2O
Datos: mA (H =1; C=12; O=16)
A) 72%
B) 82%
C) 85%
D) 90%
E) 98%
Rpta. : "D"
PREGUNTA 24 :
Para la siguiente reacción Redox:
FeS + HNO3→ Fe(NO3)3+ S + H2O + NO
Responder verdadero (V) o falso (F) según corresponda:
( ) El hierro no cambia su estado de oxidación
( ) La forma reducida es el NO
( ) Sólo el azufre se oxida perdiendo 2e–
A) VVF
B) FVF
C) VFV
D) FFV
E) FVV
Rpta. : "B"
PREGUNTA 25 :
Indique las fórmulas del alcohol etílico, del acetaldehído y del ácido acético, respectivamente.
A) CH3CH2OH; CH3CHO; HCOOH
B) CH3CH2OH; CH3CHO; CH3COOH
C) CH3CH2OH; HCHO; CH3COOH
D) CH3CH2OH; CH3CHO; CH3CH2COOH
E) CH3OH; CH3CHO; CH3COOH
Rpta. : "B"
PREGUNTA 26 :
Los jabones son compuestos que se forman a partir de los ácidos grasos que provienen de los lípidos, químicamente pertenecen a la función:
A) Éster
B) Sal
C) Amida
D) Alcohol
E) Cera
RESOLUCIÓN :
Los jabones son “sales” (generalmente de sodio y potasio) obtenidos de la reacción de un lípido y una base; dicha reacción se denomina saponificación.
Rpta. : "B"
PREGUNTA 27 :
Determine el período y el grupo al cual pertenece un átomo cuyo número atómico es 6.
A) 2, (VIII A)
B) 2, (IV A)
C) 3, (III A)
D) 3, (IV B)
E) 2, (II A)
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 28:
Señale cuál de las siguientes opciones no es una mezcla.
A) aire
B) agua de mesa
C) nube
D) mayonesa
E) ozono
RESOLUCIÓN :
El ozono no es una mezcla, es un compuesto químico, es una molécula que está constituida por la unión química d 3 átomos de oxígeno. Las demás opciones a, b, c, d son mezclas.
Rpta. : "E"
PREGUNTA 29:
Cuatro litros de un gas están a 600mmHg de presión. ¿Cuál será su nuevo volumen sí aumentamos la presión hasta 800mmHg?
A) 1 L
B) 2 L
C) 2,5 L
D) 3 L
E) 1,5 L
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 30 :
El ácido que presenta la mayor cantidad de átomos de oxígeno es el
A) ácido bórico
B) ácido peryódico
C) ácido nítrico
D) ácido brómico
E) ácido hiposelenioso
RESOLUCIÓN :
Rpta. : "B"
PREGUNTA 31 :
En la refinación del petróleo se separan sus componentes mediante:
A) Combustión reducida
B) Centrifugación diferenciada
C) Precipitación selectiva
D) Destilación fraccionada
E) Filtración continua
RESOLUCIÓN :
El proceso físico de separación de los componentes del petróleo de acuerdo a las diferencias de sus temperaturas de ebullición se denomina destilación fraccionada.
Rpta. : "D"
PREGUNTA 33 :
En relación a los recursos naturales y la industria química se puede afirmar que:
( ) Cuando los detergentes son utilizados en gran cantidad, en la industria y en el hogar, son fuente de contaminación del agua.
( ) El formaldehído usado ampliamente en la fabricación de madera prensada y enchapada tiene efectos carcinógenos.
( ) El CO2 emitido por la quema de combustibles fósiles es el principal gas que intensifica el efecto invernadero.
A) VFV
B) FVV
C) VVV
D) FVF
E) VVF
RESOLUCIÓN :
(V) Debido a la gran cantidad de fosfatos y sulfatos presentes en los detergentes estos contaminan las aguas induciéndolas a una eutrofización.
(V) Los productos de madera prensada contienen formaldehído (considerado como cancerígeno por la OMS) el cual se va evaporando poco a poco al interior de las casas.
(V) El CO2(g) es el principal gas causante del efecto invernadero, una de sus fuentes de origen es la quema de combustibles fósiles.
Rpta. : "C"
PREGUNTA 34 :
El yodo radiactivo (I-131) se emplea en:
A) Obstrucciones de la sangre.
B) Cáncer a la piel.
C) Tratamiento de la tiroides.
D) Matar gusanos.
E) Bailar mejor
RESOLUCIÓN :
El yodo radioactivo (I−131) se emplea para el tratamiento de la glándula tiroides.
Rpta. : "C"
PREGUNTA 35 :
¿Cuál de los siguientes compuestos es orgánico?
A) Ca CO3
B) CO2
C) H2CO3
D) CH4
E) CO
RESOLUCIÓN :
Rpta. : "D"
PREGUNTA 36:
El vinagre es una solución acuosa que posee efectos benéficos sobre la salud cardiovascular y contiene 5% en masa de ácido acético (CH3COOH). Si 500 mL de la solución pesan 600g, determine la molaridad de la solución.
(𝑫𝒂𝒕𝒐;masa molecular del CH3COOH=𝟔𝟎)
A) 5,00
B) 2,00
C) 3,00
D) 4,00
E) 1,00
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 37:
El ácido cítrico se emplea en pequeñas cantidades como parte de los fertilizantes agrícolas. De acuerdo con la estructura, es correcto afirmar que los grupos funcionales presentes en una molécula de ácido cítrico son:
A) Alcohol y ácido carboxílico.
B) Aldehído y alqueno
C) Cetona y aldehído
D) Alcohol y éster
E) Cetona y éster.
RESOLUCIÓN :
El ácido cítrico en su fórmula presenta −𝐶𝑂𝑂𝐻 y −𝑂𝐻. Los cuales corresponden a los grupos funcionales hidroxilo y carboxilo, el cual es característico de las funciones alcohol y ácido.
Rpta. : "A"