QUÍMICA UNSAAC PRUEBA RESUELTA SAN ANTONIO DE ABAD INGRESO UNIVERSIDAD
PREGUNTA 1 :
Identifica a qué familia de la tabla periódica actual corresponden los elementos litio y sodio.
A) halógenos
B) carbonoides
C) boroides
D) gases nobles
E) metales alcalinos
RESOLUCIÓN :
Un grupo o familia es el orden vertical de los elementos con propiedades químicas similares. En forma tradicional se tienen 8 grupos A y 8 grupos B. El litio (Li) y sodio (Na) pertenecen al grupo IA que se denominan metales alcalinos, ya que al reaccionar dejan cenizas.
Rpta. : "E"
PREGUNTA 2 :
¿Qué proposición hace referencia a una propiedad química?
A) El azúcar es soluble en agua.
B) El oxígeno molecular hierve a −183°C.
C) La luz ultravioleta interviene en la producción de O3 a partir de O2
D) El hielo es menos denso que el agua.
E) La solución acuosa de KMnO4 presenta color violeta.
RESOLUCIÓN :
Propiedad física: es cualquier propiedad de una sustancia que se puede analizar sin transformar la sustancia en alguna otra.
Propiedad química: es cualquier propiedad de una sustancia que no puede ser estudiada sin la conversión de la sustancia en alguna otra.
Analizando las alternativas reconocemos que la solubilidad, la temperatura de ebullición (hervor de un líquido), la densidad son propiedades físicas intensivas de la materia.
Rpta. : "C"
PREGUNTA 3 :
En la figura se observa un recipiente abierto, determina el número de fases que existe:
A) 5
B) 1
C) 2
D) 3
E) 4
RESOLUCIÓN :
Toda materia homogénea (sustancia o mezcla homogénea) constituye una sola fase. En el recipiente abierto tenemos:
∴ Número fases=5
Rpta. : "A"
PREGUNTA 4 :
Identifique el par de especies químicas que son isoelectrónicas:
A) 25Mn2+ y 26Fe3+
B) 20Ca y 22Ti2+
C) 38Sr y 40Zr2+
D) 24Cr y 27Co3+
E) 19K y 21Sc2+
RESOLUCIÓN :
Especies isoelectrónicas son átomos de diferentes elementos que presentan igual configuración electrónica.
Rpta. : "A"
PREGUNTA 5 :
Se tiene el ion 20Ca2+, luego evalúa:
I) La distribución electrónica del átomo neutro es [18Ar] 4s2
II) El ion tiene nueve orbitales apareados.
III) El ion tiene 20 electrones en su nube electrónica.
A) VVV
B) FVV
C) FFF
D) FFV
E) VVF
RESOLUCIÓN :
Rpta. : "E"
PREGUNTA 6 :
Los metales alcalinotérreos son elementos de la tabla periódica más duros y menos reactivos que los metales alcalinos. Identifique al elemento que no es un metal alcalinotérreo.
A) 20Ca
B) 12Mg
C) 29Cu
D) 56Ba
E) 38Sr
RESOLUCIÓN :
Ubicando los elementos en base a su configuración electrónica:
Rpta. : "C"
PREGUNTA 8 :
Indique la relación nombre-fórmula química correcta:
A) Hexacloruro de fósforo, PCℓ5
B) Manganato de calcio, CaMnO4
C) Cloruro de bario, Ba(CℓO2)2
D) Nitrato de potasio, KNO2
E) Clorito de sodio, NaCℓO
RESOLUCIÓN :
A) Incorrecta
PCℓ5: Pentacloruro de fósforo
B) Correcta
Manganato de calcio Ca2+ MnO4– 2=CaMnO4
C) Incorrecta
Cloruro de bario Ba2+ Cℓ1–=BaCℓ2
D) Incorrecta
Nitrato de potasio K+1 NO3– 1=KNO3
E) Incorrecta
Clorito de sodio Na+1 ClO2– 1=NaCℓO2
Rpta. : "B"
PREGUNTA 10 :
Respecto a las propiedades periódicas, ¿cuál de las siguientes proposiciones es la correcta?
A) El radio atómico se mantiene constante en todos los elementos de un mismo período.
B) La electronegatividad es la energía que un átomo libera cuando atrae electrones hacia sí mismo, estando químicamente enlazado a otro átomo.
C) La energía de ionización, también denominada potencial de ionización, disminuye a medida que el número atómico aumenta en un grupo en la tabla periódica.
D) El carácter metálico aumenta en un período de izquierda a derecha.
E) Para un elemento A, se cumple que el radio del catión A+ es mayor que el radio del átomo A.
RESOLUCIÓN :
A. Incorrecta
El radio atómico disminuye a lo largo de un periodo de izquierda a derecha.
B. Incorrecta
La electronegatividad es una fuerza relativa con la que los átomos atraen a los electrones del enlace químico.
C. Correcta
La energía de ionización es la mínima energía que se requiere para sustraer un electrón de la capa de valencia de un átomo en su fase gaseosa y estado basal.
D. Incorrecta
El carácter metálico aumenta de derecha a izquierda en la tabla periódica.
E. Incorrecta
El radio catiónico es menor al radio atómico neutro.
La energía de ionización es la mínima energía que se requiere para sustraer un electrón de la capa de valencia de un átomo en su fase gaseosa y estado basal.
Rpta. : "C"
PREGUNTA 11 :
¿Cuáles de las siguientes proposiciones son correctas?
I) A temperatura ambiente, los compuestos iónicos son sólidos.
II) Los sólidos iónicos, debido a las especies con carga eléctrica que los constituyen, son excelentes conductores de la electricidad.
III) La mayoría de compuestos iónicos son sólidos amorfos.
A) Solo I
B) Solo II
C) Solo III
D) I y II
E) II y III
RESOLUCIÓN :
I. Correcta
Todo compuesto iónico a temperatura ambiente (20°C - 25°C) son sólidos.
II. Incorrecta
Los compuestos iónicos sólidos (los iones solo vibran), por ello no son conductores eléctricos. Para ser conductor eléctrico debería decir fundidos o disueltos en agua.
III. Incorrecta
En general, los compuestos iónicos son sólidos cristalinos (sus iones se repiten en forma ordenada y periódicas de manera tridimensional).
Rpta. : "A"
PREGUNTA 12 :
Identifica cuál es la fórmula correcta del alcohol etílico.
A) CH3OH
B) C4H9OH
C) C2H5OH
D) C3H5OH
E) C2H2OH
RESOLUCIÓN :
Los alcoholes son compuestos ternarios moleculares cuyo grupo funcional es el hidroxilo (–OH).
Fórmula general: R − OH
R: grupo alquilo
CH3OH: alcohol metílico
C2H5OH: alcohol etílico
Rpta. : "C"
PREGUNTA 13 :
El mol es la unidad de la magnitud “cantidad de sustancia” en el Sistema Internacional y es una medida de la cantidad de partículas (átomos, moléculas, iones) de una sustancia. Para una masa de 1640 g de acetato de sodio (NaCH3COO), indique la proposición correcta: Masas atómicas: H=1; C=12; O=16; Na=23
A) Contiene 40 moles de átomos de oxígeno (O).
B) Contiene 23 moles de iones sodio (Na +).
C) Contiene 12 moles de átomos de carbono (C).
D) Contiene 1 mol de iones acetato (CH3COO–)
E) Contiene 6 moles de átomos de hidrógeno (H).
RESOLUCIÓN :
Rpta. : "A"
PREGUNTA 14 :
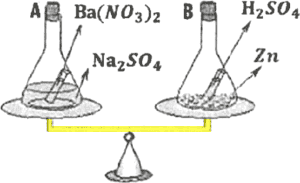
Un experimento se inicia con cantidades de sustancias tales que los brazos de la balanza quedan igualados; luego el contenido de los tubos de ensayo que están dentro se dejan caer para que se mezclen las sustancias. Con esa información, indique la alternativa correcta.
A) Al final la balanza se inclina hacia abajo a la izquierda, porque en el brazo izquierdo se forma un precipitado.
B) Al final la balanza se inclina hacia abajo a la izquierda, porque en el brazo derecho se forma un gas.
C) Al final la balanza no se mueve, porque no hay ningún tipo de reacción.
D) Al final la balanza se inclina abajo a la derecha, ya que en el brazo izquierdo no ocurre reacción, pero sí en el derecho.
E) Al final la balanza no se mueve, aunque ocurran reacciones.
RESOLUCIÓN :
Se verifica la ley de la conservación de la masa, dada por Antonie Lavoisier, en ambos platillos la materia no se crea ni se destruye solo se transforma por estar en constante cambio y movimiento, esto debido a que ambos sistemas son cerrados (no hay un intercambio de materia con el entorno).
Rpta. : "E"
PREGUNTA 16 :
Dada la reacción en equilibrio químico a 817 °C:
C(s)+CO2(g) + calor ⇄ 2CO(g)
¿Cuál de los siguientes cambios producen un aumento de la concentración de CO?
A) Aumento de la presión
B) Disminución de la temperatura
C) Adición de carbono
D) Aumento del volumen del reactor
E) Adición de un catalizador
RESOLUCIÓN :
Según el principio de Le Chatelier, si una reacción está en equilibrio y es alterado, el sistema buscará un nuevo equilibrio y para ello contrarestará lo que lo alteró, desplazandose hacia la derecha o izquierda el sentido de la reacción.
Rpta. : "D"
PREGUNTA 17 :
Las soluciones son mezclas homogéneas cuyos componentes son soluto y solvente. ¿Cuál de las siguientes alternativas corresponde a una solución?
A) Neblina
B) Mayonesa
C) Gelatina
D) Bronce
E) Propanona
RESOLUCIÓN :
Respecto a su tipo de dispersión se tiene:
Coloides: Neblina, mayonesa, gelatina
Solución sólida: Bronce (Sn+Cu)
la propanona (acetona) CH3COCH3 corresponde a una sustancia compuesta y no a una dispersión.
Rpta. : "D"