CONFIGURACIÓN ELECTRÓNICA EJERCICIOS RESUELTOS PDF
PROBLEMA 1 :
¿Cuántos niveles tiene un átomo de Z=29?
A) 5
B) 3
C) 4
D) 6
E) 2
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 2 :
La configuración electrónica de un átomo se basa en los principios de exclusión de Pauli, en el de máxima multiplicidad de Hund y en el del Aufbau (regla del serrucho).
Con respecto a la configuración electrónica, señale la combinación correcta, después de determinar si la proposición es verdadera (V) o falsa (F).
I) El principio de exclusión de Pauli permite tener dos electrones como máximo en un orbital atómico.
II) El principio de máxima multiplicidad de Hund se aplica a subniveles de energía con orbitales atómicos degenerados.
III) La configuración electrónica del boro (Z=5) es 1s²2s²2p¹.
A) FVV
B) VFV
C) FFF
D) VVV
E) VVF
RESOLUCIÓN :
I) Verdadera
El principio de exclusión de Pauli plantea que en un átomo no pueden existir dos electrones con sus cuatro números cuánticos iguales; al menos deben diferenciarse en el espín (ms).
II) Verdadera
El principio de máxima multiplicidad plantea que al asignar electrones a los orbitales primero se busca colocar un electrón a todos los orbitales con energías similares (también llamados orbitales degenerados) antes de aparearse los electrones en un orbital semilleno.
III) Verdadera
5B: 1s²2s²2p¹
Rpta. : "D"
PROBLEMA 3 :
La configuración electrónica del uranio es
Al respecto, las afirmaciones correctas son:
I) En el nivel 5 hay 4 electrones con número cuántico ℓ=3.
II) Los 4 electrones del subnivel 5f tienen diferentes números cuánticos ms.
III) El uranio no contiene electrones en el nivel n= 6
A) I y II
B) II y III
C) solo II
D) solo I
E) I, II y III
RESOLUCIÓN :
Rpta. : "D"
PROBLEMA 4 :
Determine el mínimo y máximo número de electrones que puede tener un elemento cuya configuración electrónica llega hasta el nivel 4.
A) 36, 36
B) 30, 19
C) 19, 30
D) 36, 19
E) 19, 36
RESOLUCIÓN :
Rpta. : "E"
PROBLEMA 5 :
Un átomo que posee la configuración electrónica
1s22s2 2p6 3s2 3p6 3d5 4s1
le corresponde a un elemento:
A) De transición
B) Gas noble
C) Alcalino térreo
D) Anfígeno
E) Halógeno
RESOLUCIÓN :
Rpta. : "A"
PROBLEMA 6 :
El cloruro de magnesio:
(MgCℓ2)(12Mg, 17Cℓ) es una sal haloidea que se usa como lubricante de hilos, como suplemento alimenticio, en la fabricación de papel, etc.
Identifique sus configuraciones electrónicas de catión y anión, respectivamente.
A) 1s² 2s²2p⁶ ; 1s²2s²2p⁶3s²3p⁶
B) 1s²2s²2p⁶3s¹ ; 1s²2s²2p⁶3s²3p⁵
C) 1s²2s²2p⁶3s¹ ; 1s²2s²2p⁶3s²3p⁶
D) 1s²2s²2p⁶1s² ; 2s²2p⁶3s²3p⁵
RESOLUCIÓN :
Rpta. : "A"
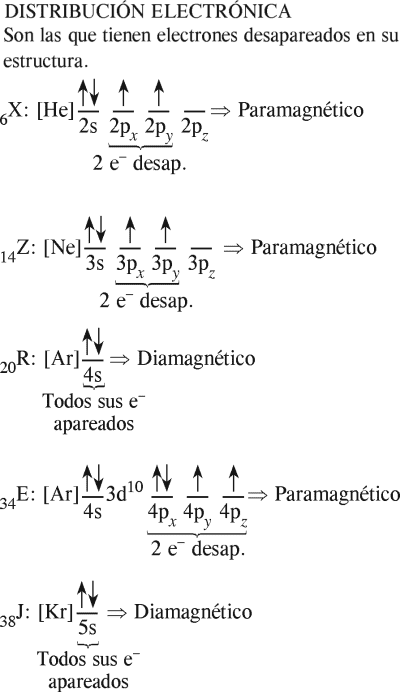
PROBLEMA 7 :
Tenemos los elementos
6X , 14Z , 20R , 34E y 38J
Identifique los elementos con propiedades paramagnéticas.
A) R, E, J
B) Z, R, E
C) X, Z, E
D) Z, R, J
E) X, E, J
RESOLUCIÓN :
Rpta. : "C"
PROBLEMA 8 :
¿Cuál de las siguientes especies químicas es diamagnética?
A) 5B
B) 7N
C) 12Mg+1
D) 3Li2+
E) 9F–1
RESOLUCIÓN :
SUSTANCIA DIAMAGNÉTICA
Son aquellos que no son atraídos por el campo magnético (imán), o en algunos casos son levemente repelidos. Por lo tanto, si los electrones se hallan apareados, muestran espines opuestos, entonces no existe un campo magnético neto, y es cuando se produce el diamagnetismo.
9F–1= 1s22s22p6
Todos sus electrones apareados, por lo tanto es una especie diamagnética.
Rpta. : "E"
PRIMERA PRACTICA
EJERCICIO 1 :
Un átomo posee 7 electrones en su cuarto nivel energético. Determina su número atómico.
A) 27
B) 25
C) 35
D) 37
E) 29
EJERCICIO 2 :
Un átomo posee 5 electrones en la capa “M” . Si posee 31 nucleones fundamentales en su núcleo. Determina cuántos neutrones posee.
A) 13
B) 14
C) 15
D) 16
E) 17
EJERCICIO 3 :
¿Cuántos electrones posee en su último nivel el silicio: 2814Si ?
A) 2
B) 3
C) 4
D) 5
E) 6
EJERCICIO 4 :
¿Cuántos electrones en los subniveles “s” posee el 8737Rb?
A) 2
B) 6
C) 7
D) 9
E) 1
EJERCICIO 5 :
¿Cuántos electrones posee el 7131As?
A) 1
B) 2
C) 3
D) 11
E) 13
EJERCICIO 6 :
¿Cuántos electrones posee en su último nivel el átomo de cloro: 3517Cℓ ?
A) 2
B) 3
C) 5
D) 6
E) 7
EJERCICIO 7 :
Determina la configuración electrónica por niveles para el 7031Ga
a) 2, 8, 18, 1
b) 2, 8, 18, 5
c) 2, 8, 18, 3
d) 2, 8, 8, 11
e) 1, 8, 12, 1
EJERCICIO 8 :
¿Cuántos subniveles llenos posee el selenio: 7934Se?
A) 7
B) 6
C) 5
D) 4
E) 3
EJERCICIO 9 :
¿Cuántos electrones posee el 7533As en su subnivel mas energético?
A) 2
B) 3
C) 12
D) 10
E) 5
EJERCICIO 10 :
Un átomo posee 3 electrones en su cuarto nivel energético. Determina su número atómico.
A) 31
B) 23
C) 33
D) 27
E) 41
EJERCICIO 11 :
El manganeso posee 55 nucleones fundamentales y 25 protones. ¿Cuántos electrones posee en su último nivel energético?
A) 2
B) 5
C) 7
D) 3
E) 1
EJERCICIO 12 :
¿Cuántos subniveles llenos posee el calcio: 4020Ca?
A) 4
B) 5
C) 6
D) 7
E) 8
EJERCICIO 13 :
Un átomo posee 6 electrones en la capa “N”. Si posee 45 neutrones en su núcleo. Determina su número de masa.
A) 67
B) 69
C) 77
D) 79
E) 81
EJERCICIO 14 :
El zinc posee 65 nucleones fundamentales y 35 neutrones.
¿Cuántos electrones posee en su último nivel energético?
A) 2
B) 5
C) 7
D) 10
E) 12
EJERCICIO 15 :
¿Cuántos electrones en los sub niveles “p” posee el 8035Br?
A) 6
B) 12
C) 18
D) 11
E) 17
CLAVES – RESPUESTAS :
1)C 2)D 3)E 4)D 5)A 6)E 7)C 8)D 9)E 10)A 11)A 12)C 13)D 14)A 15)E
SEGUNDA PRACTICA
PROBLEMA 1 :
El ion cobre (II), 29Cu2+, es importante para muchas funciones en el cuerpo, tales como la pigmentación de la piel, la obtención de huesos fuertes, entre otros. En el cuerpo humano la ceruloplasmina es la proteína producida en el hígado encargada de almacenar y transportar el ion cobre (II), hacia el torrente sanguíneo.
Con respecto a este ion y a su átomo neutro, seleccione la alternativa correcta.
A) El ion presenta siete electrones en su último subnivel.
B) El átomo neutro presenta dos electrones en su último nivel.
C) El ion tiene doce orbitales llenos y tres electrones desapareados.
D) El átomo neutro contiene ocho electrones con ℓ =0
E) Los números cuánticos para el último electrón del ion son (3, 2, +1, –1/2)
Rpta. : "E"
PROBLEMA 2 :
El selenio (Z=34) es un nutriente importante para el funcionamiento del sistema inmunitario, sistema nervioso, músculos y glándula tiroides. Los principales alimentos que contienen selenio son las nueces de Brasil, la carne de cerdo, semillas de girasol, entre otros.
Con respecto al elemento, seleccione la alternativa con el enunciado correcto.
A) Posee cuatro niveles de energía llenos.
B) Tiene solo doce electrones con ℓ=1.
C) Presenta ocho subniveles de energía llenos.
D) Posee 17 orbitales llenos y ningún electrón desapareado.
E) Los números cuánticos para su ultimo electrón son (4, 1, –1, –1/2).
Rpta. : "E"
PROBLEMA 3 :
La vitamina B12 tiene un papel muy importante en la formación de glóbulos rojos, la función nerviosa y contribuye a la formación del ADN, sus fuentes más importantes son las carnes de aves, de vaca y pescado, y su deficiencia puede causar anemia, fatiga y debilidad muscular. Una molécula de vitamina B12 contiene a un catión trivalente cuyos números cuánticos de su último electrón son (3, 2, –2, –1/2).
Respecto a dicho ion y su átomo neutro, determine el valor de verdad (V o F) de las siguientes proposiciones.
I) El ion presenta cuatro electrones desapareados.
II) El átomo neutro tiene doce orbitales llenos y tres semillenos.
III) El ion tiene dos electrones en su nivel de mayor energía.
A) FFV
B) FVF
C) VVF
D) VFF
E) VFV
Rpta. : "C"
PROBLEMA 4 :
El ion potasio, 19K+, es el principal catión del líquido intracelular asociado con el metabolismo de carbohidratos y en la síntesis de proteínas. Una de las causas de su deficiencia son los problemas renales debido a su eliminación excesiva a través de la orina, lo cual a su vez causa también deficiencia de iones cloruro, 17Cℓ–, por lo cual una forma de compensar el déficit de dichos iones es consumiendo medicamentos que contengan cloruro de potasio.
Con respecto a los iones mencionados, determine el valor de verdad (V o F) de las siguientes proposiciones:
I) El catión presenta cuatro niveles de energía y 9 orbitales llenos.
II) El penúltimo electrón del anión tiene los números cuánticos (3, 1, +1, –1/2)
III) Ambos iones son isoelectrónicos entre sí.
A) VVV
B) FFV
C) FVF
D) VVF
E) VFV
Rpta. : "B"
EJERCICIO 5 :
El curtido consiste en transformar el colágeno de la piel del cerdo en cuero, para ello se emplean sales que contienen al ion cromo trivalente, 24Cr3+. Después de la curtiembre, el cromo que no es absorbido por el cuero es reciclado debido a sus potenciales riesgos si se vierte al ambiente.
Con respecto al ion y su átomo neutro, seleccione las proposiciones INCORRECTAS.
I) El átomo neutro tiene dos electrones en el último nivel de energía.
II) El ion presenta nueve orbitales llenos y seis electrones desapareados.
III) Los números cuánticos para el último electrón del ion son (3, 2, 0, +1/2).
A) Solo I
B) II y III
C) Solo III
D) I y II
E) Solo II
Rpta. : "D"
EJERCICIO 6 :
Los metales y sus óxidos tienen diversas aplicaciones, por ejemplo, el níquel (Z=28) se utiliza en aleaciones empleadas en la industria automotriz en la fabricación de motores, engranajes, pistones, entre otros accesorios. En tanto, el óxido de zinc constituido por iones 30Zn2+ y ion óxido, 8O2–, se emplea en la elaboración de cosméticos debido a sus efectos en la piel, la protege de los rayos UV, la cicatriza, la desinflama, entre otros.
Al respecto, determine el valor de verdad (V o F) de las siguientes proposiciones.
I) El níquel y el ion zinc tienen distribuidos sus electrones en cuatro niveles de energía.
II) Los números cuánticos del penúltimo electrón del ion óxido son (2, 1, 0, –1/2)
III) El ion zinc es isoelectrónico con el níquel, ya que ambos tiene 28 electrones.
A) VFV
B) FVF
C) FFV
D) VVF
E) VVV
Rpta. : "B"